汽车尾气(含烃类、CO、SO2与NO等有毒气体)是城市空气的污染源。治理方法之一是在汽车的排气管上装一个“催化转换器”(用Pt、Pd合金作催化剂),它的特点是使CO和NO反应,生成参与大气生态循环的无毒气体,并使汽油充分燃烧及SO2转化。
(1)写出NO和CO通过催化转换器发生反应的化学方程式__________________________。
(2)“催化转换器”的缺点是在一定程度上提高了空气的酸度,其原因是_______________________________________。
(3)控制城市空气污染源的方法有 (填写字母序号)。
a.植树造林 b.开发氢能源 c.尾气达标排放 d.使用含铅汽油
锶(Sr)为第五周期ⅡA族元素,其化合物六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如下: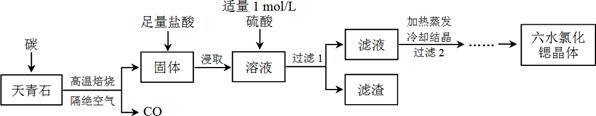
已知:① 经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质;
② SrSO4、BaSO4的溶度积常数分别为3.3×10-7、1.1×10-10;
③ SrCl2·6H2O的摩尔质量为:267 g/mol。
(1)天青石焙烧前先研磨粉碎,其目的是_________________________________________。
(2)隔绝空气高温焙烧,若0.5 mol SrSO4中只有S被还原,转移了4 mol电子。写出该反应的化学方程式:_____________________________________________。
(3)为了得到较纯的六水氯化锶晶体,过滤2后还需进行的两步操作是_______________。
(4)加入硫酸的目的是______________________。为了提高原料的利用率,滤液中Sr2+的浓度应不高于_________ mol/L(注:此时滤液中Ba2+浓度为1×10-5 mol/L)。
(5)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×10-2 mol的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应的离子),待Cl―完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_________________________________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为______________(保留4位有效数字)。
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物:
①CH4 (g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) ΔH=-570 kJ·mol-1
②CH4(g)+4NO(g)="=2" N2(g) +CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
则CH4 (g)+2NO2(g)="=" N2(g)+CO2(g)+2H2O(g)ΔH=___________。
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知在压强为a MPa下,该反应在不同温度、不同投料比时,CO2的转化率见下图:
①此反应为(填“放热”、“吸热”);若温度不变,提高投料比[n(H2)/n(CO2)],则K将________(填“增大”、“减小”或“不变”)。
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池正极的电极反应式_______________________。
③在a MPa和一定温度下,将6 mol H2和2 mol CO2在2 L密闭容器中混合,当该反应达到平衡时,测得平衡混合气中CH3OCH3的体积分数约为16.7%(即1/6),此时CO2的转化率是多少?(计算结果保留2位有效数字)
④在a MPa和500K下,将10mol H2和5 mol CO2在2 L密闭容器中混合,5min达到平衡,请在答题卡的坐标图中画出H2浓度变化图。(请标出相应的数据)
研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
| 离子 |
离子半径(pm) |
开始沉淀 时的pH |
完全沉淀 时的pH |
| Fe2+ |
74 |
7.6 |
9.7 |
| Fe3+ |
64 |
2.7 |
3.7 |
| Al3+ |
50 |
3.8 |
4.7 |
| Mn2+ |
80 |
8.3 |
9.8 |
| Pb2+ |
121 |
8.0 |
8.8 |
| Ca2+ |
99 |
- |
- |

请回答下列问题:
(1)写出浸出过程中生成Mn2+反应的化学方程式。
(2)氧化过程中主要反应的离子方程式。
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是,应调节pH的范围为。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有、等;吸附步骤除去的主要离子为:。
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2 mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是 。
对大气污染物SO2、NOx进行研究具有重要环保意义。请回答下列问题:
(1)为减少SO2的排放,常采取的措施是将煤转化为清洁气体燃料。
已知:① H2(g)+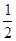 O2(g)=H2O(g)△H=-241.8kJ·mol-1
O2(g)=H2O(g)△H=-241.8kJ·mol-1
②C(s)+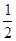 O2(g)=CO(g)△H=-110.5kJ·mol-1
O2(g)=CO(g)△H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:。
(2)已知汽车汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H
2NO(g) △H 0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在2.0 L密闭汽缸内经过5s反应达到平衡,测得NO为1.6×10-3mol。
0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在2.0 L密闭汽缸内经过5s反应达到平衡,测得NO为1.6×10-3mol。
①在1300oC 时,该反应的平衡常数表达式K=。5s内该反应的平均速率ν(N2) = (保留2位有效数字);
②汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是。
(3)汽车尾气中NO和CO的转化。当催化剂质量一定时,增大催化剂固体的表面积可提高化学反应速率。下图表示在其他条件不变时,反应2NO(g)+2CO(g) 2CO2(g)+N2(g) 中,NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g)+N2(g) 中,NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
①该反应的△H0 (填“>”或“<”)。
②若催化剂的表面积S1>S2,在右图中画出c(NO) 在T1、S2条件下达到平衡过程中的变化曲线(并作相应标注)。
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下: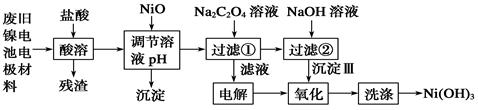
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。②K (Ni(OH)
(Ni(OH) ): 5.0×10-16 ,K
): 5.0×10-16 ,K (NiC2O4): 4.0×10-10
(NiC2O4): 4.0×10-10
回答下列问题:
(1)酸溶后所留残渣的主要成份(填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);用pH试纸测定某溶液pH的具体操作是。
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式,该反应的平衡常数为。
(5)沉淀Ⅲ可被电解所得产物之一(填化学式)氧化生成Ni(OH)3 ,如何洗涤Ni(OH)3 沉淀?
。