下列离子方程式正确的是( )
| A.向石灰水中通入过量CO2: CO2+ O H —=HCO3 — |
| B.金属钠投入水中:Na + H2O=Na+ + OH-+ H2↑ |
| C.将少量H2SO4溶液滴加到Ba(OH)2溶液中H++SO42-+OH—+Ba2+=BaSO4↓+H2O |
| D.将铁粉加入到AgNO3溶液中Fe+Ag+=Ag+Fe2+ |
下列实验操作合理的是
| A.不用其它试剂鉴别NaCl、Na2CO3、NaHSO4、AlCl3四种溶液 |
| B.液溴应盛放在用水密封且用橡胶塞塞紧的棕色试剂瓶中 |
| C.用浓盐酸酸化KMnO4溶液以增强KMnO4溶液的氧化性 |
D.将SO2气体通入溴水,欲检验是否有SO 生成,可向溶液中滴加Ba(NO3)2溶液 生成,可向溶液中滴加Ba(NO3)2溶液 |
在碱性条件下能够大量共存,而在强酸性条件下却能发生氧化还原反应的离子组是
| A.Ca2+、AlO2-、SO42-、Cl- |
| B.K+、Na+、ClO-、Cl- |
| C.Na+、Fe2+、NO3-、SO42- |
| D.NH4+、Na+、F-、CO32- |
2010年世界博览会已于2010 年5月1日至10月31日在中国上海举行。为了贯彻生态、环保、绿色世博的理念,下列措施中不合理的是
| A.在世博园区进行大规模绿化建设,提高绿化面积w |
| B.建立空调凝结水和屋面雨水收集系统,充分利用水资源 |
| C.将世博园区的垃圾收集起来进行集中焚烧或深埋处理 |
| D.在建筑、布展、运营过程中应用大规模的太阳能光伏发电系统 |
著名化学家徐光宪,因为在稀土萃取领域取得了卓越成就而获得“国家最高科学技术奖”,被誉为“稀土界的袁隆平”。已知:稀土金属铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4;氧化性:Ce4+>Fe3+。)下列说法正确的是
A.四种核素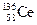 、 、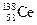 、 、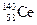 、 、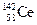 ,它们互称为同素异形体 ,它们互称为同素异形体 |
| B.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI ="==" CeI4 + 2H2↑ |
| C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈 |
| D.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + 2Fe2+ ="==" Ce3+ + 2Fe3+ |
NA表示阿伏加德罗常数的值,下列说法正确的是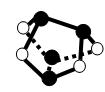
| A. 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
| B. 12.5mL 16mol·L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
| C.7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| D.0.5mol雄黄(As4S4,结构如上图)含有NA个S—S键 |