现有A、B、C、D、E五种强电解质,他们在水中可电离产生下列离子(每种电解质电离时只产生一种阳离子,而且不重复)。
| 阳离子 |
H+、Na+、Al3+、Ag+、 Ba2+ |
| 阴离子 |
OH-、 Cl-、CO32-、NO3-、SO42- |
已知:①A、B两溶液呈碱性; C、D、E溶液呈酸性。
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失。
③D溶液与另外四种溶液反应都能产生沉淀。
试回答下列问题:
(1)A溶液呈碱性的原因是(用离子方程式表示) ;
(2)写出E溶液与过量B溶液反应的离子方程式 ;
(3)若25℃时C、E溶液PH=4,则E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子浓度的 倍;
(4)将C溶液逐滴加入等体积、等物质的量浓度的A溶液中反应后溶液中的一价(+1和-1)离子浓度由大到小的顺序为 。
附加题
Ⅰ:如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和
1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g) 2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题: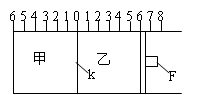
(1)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是 。
(2)若达到平衡时,隔板K最终停留在左侧刻度1处,此时甲容积为2L,反应化学平衡常数为____。
(3)若达到平衡时,隔板K最终停留在左侧刻度靠近0处, 则乙中可移动活塞F最终停留在右侧的刻度不大于 ;
Ⅱ:若一开始就将K、F固定,其它条件均不变,则达到平衡时:
(1)测得甲中A的转化率为b,则乙中C的转化率为 ;
(2)假设乙、甲两容器中的压强比用d表示,则d的取值范围是 。
有甲乙两个容积均为1L的密闭容器,在控制两容器的温度相同且恒定的情况下进行反应:2A(g)+B(g) xC(g),①向甲中通入4molA、2molB,达平衡时测得其中C的体积分数为40%;②向乙中通入1molA、0.5molB和3molC,平衡时测得C的体积分数为W%。试回答:
xC(g),①向甲中通入4molA、2molB,达平衡时测得其中C的体积分数为40%;②向乙中通入1molA、0.5molB和3molC,平衡时测得C的体积分数为W%。试回答:
(1)甲平衡时A的体积分数为 ;
(2)若乙W%=40%,且建立平衡的过程中乙压强有变化 ,则x= ,乙中建立平衡时压强的变化为 (填“递增”或“递减”);
(3)若乙W%=40%,且平衡时甲、乙压强不同,则x= ,平衡时甲的压强 乙的压强(填“大于”或“小于”),乙平衡时c(A)= ;
(4)若x=4,则W% 40%(填“大于”、“小于”或“等于”,下同);平衡时乙中的c(A) 甲中的c(A)。
现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1
的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=________;
(2)丙溶液中存在的所有电离平衡为_____________________________(用电离方程式表示);
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为________;
有以下物质:①石墨;②铝;③酒精;④氨水;⑤二氧化碳;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧纯醋酸;⑨氧化钠固体;⑩氯化氢气体。
(1)其中能导电的是 ;属于非电解质的是 ;属于强电解质的是 ;属于弱电解质的是 。
(2)写出物质⑥溶于水的电离方程式: 。
(3)写出物质⑥和⑧在水中反应的离子方程式: 。
(4)将物质⑥配制成溶液,逐滴加入⑦溶液中至沉淀量最大,写出离子方程式: ,检验离子沉淀完全的方法是 ,洗涤沉淀的方法是 。
在一定条件下,Fe2O3 + 3CO 2Fe + 3CO2反应中, (填名称)是氧化剂, (填化学式)发生氧化反应, (填元素符号)元素被氧化,生成42g Fe时转移的电子的物质的量是mol .
2Fe + 3CO2反应中, (填名称)是氧化剂, (填化学式)发生氧化反应, (填元素符号)元素被氧化,生成42g Fe时转移的电子的物质的量是mol .