在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应: N2(g)+3H2(g) 2NH3(g) △H <0
2NH3(g) △H <0
(1)该反应450℃的平衡常数 500℃时的平衡常数(填“>”、“<”或“=”);
(2)下列描述中能说明上述反应已达平衡的是
a.3v正(H2)=2v逆(NH3) b.容器中气体的平均相对分子量不随时间而变化
c.容器中气体的密度 不随时间而变化 d.容器中气体的分子总数不随时间而变化
不随时间而变化 d.容器中气体的分子总数不随时间而变化
(3)上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol
计算从反应开始到平衡时,平均反应速率v(N2)为 mol/(L·min)
(4)保持其他条件不变,若初始投入量为amolN2、bmolH2、cmolNH3,也可得到与上述相同的平衡,则a、b、c需满足关系式: ;
(5)第5分钟末,保持其它条件不变, 若继续通入0.2 mol的N2和0.6 mol的H2,
则平衡 移动(填“向正反应方向”“向逆反应方向”或“不”)。
(1)为了验证Fe3 +与Cu2+氧化性强弱,下列装置能达到实验目的的是___________
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。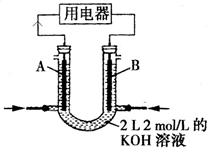
①_______处电极入口通甲烷(填A或B),其电极反应式为_______________________________
_________________________________________
②当消耗甲烷的体积为22.4L(标准状况下)时, 假设电池的能量转化率为100%,则导线中转移电子的物质的量为 ,消耗KOH的物质的量为_____________________。
(1)某温度时,在2 L密闭容器中,X、Y、Z三种物质的物质的量随时间变化曲线如下图所示。由图中数据分析,该反应的化学方程式为:____________________________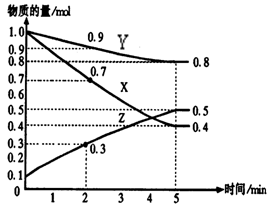
(2) 用Z表示从0—2min内该反应的平均反应速率为
____________________
(3) 某时刻t(t﹤5min)测得Y、Z两者的物质的量之比为
3:1,则X的转化率为_________
(4) 该条件下,能说明反应已达到平衡状态的是
a.容器内z物质的量浓度为0.25mol/L
b.正反应和逆反应的速率都为0
c.容器内X、Y、Z物质的量之比为1∶3∶2
d.容器内X气体的体积分数不变
e. 单位时间内消耗3a mol X,同时生成2a mol Z
(10分)某同学设计了如图所示的装置(夹持装置已略去)来探究影响化学反应速率的因素。
(1)圆底烧瓶中发生反应的离子方程式是
__________________________________________
(2)用上述装置进行实验,以生成15.0mL气体为计时终点,
结果为t1﹥t2
| 序号 |
Ⅴ(H2SO4)/mL |
C(H2SO4)/mol·L-1 |
t/s |
| Ⅰ |
10 |
1 |
t1 |
| Ⅱ |
10 |
3 |
t2 |
比较实验Ⅰ和实验Ⅱ可以得出的结论是__________________________________________
(3)实验中向烧瓶中滴入的稀硫酸的体积(其他操作都正确),对测定气体体积的影响_____ __________ (填“偏大”、“偏小”、“无影响”)
(4)将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含的杂质可能是(填序号)________
a.石墨 b.银 c.铜 d.沙粒(二氧化硅)
(5)要加快该反应的反应速率,还可以采取的措施有________________________(任填一种即可)
(11分)A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A有多种核素,其中一种没有中子;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不同的多种化合物。请回答下列问题:
(1) F在元素周期表中的位置是_______________;用电子式表示A与F两种元素组成的化合物的
形成过程______________________________________________。
已知下表中的数据是破坏1 mol物质中的化学键所吸收的能量(kJ),元素A的单质与元素F的单质在一定条件下反应生成2mol产物时释放的能量为____________kJ。
| 化学键 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2 |
| 能量(kJ) |
243 |
193 |
151 |
432 |
366 |
298 |
436 |
(2)用离子方程式表示E、F两种元素的非金属性强弱
还可以验证E、F两种元素非金属强弱的是(填写字母)
A.比较这两种元素的常见单质的沸点
B.比较这两种元素的单质与氢气化合的难易
C.比较这两种元素的最高价氧化物水化物的酸性
(3) A、C、E两两之间可形成甲、乙两种微粒,它们均为带一个单位负电荷的双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为
如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要的固氮反应。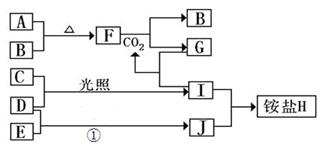
(1)单质E的结构式_____________
(2)F和H2O反应的化学方程式为_____________________________,该反应中被氧化与被还原的物质的物质的量之比是_________________
(3)铵盐H中阳离子的电子式_______________,检验H 中阳离子的方法是____________________
_____________________________________________________________________________