已知A、B、C、D为气体,其中A为黄绿色,D极易溶于水,形成的溶液可使酚酞变红,它们之间的转化关系如下图①所示:
(1)将气体B点燃,把导管伸入盛满气体A的集气瓶,反应过程中的实验现象有 (填序号)。
①放热 ②黄绿色褪去 ③瓶口有白雾 ④瓶口有白烟
⑤安静燃烧,发出黄色火焰 ⑥安静燃烧,发出苍白色火焰
(2)实验室制D的化学方程式为 。
(3)实验室可用如上图②所示装置收集D,下列叙述正确的是 (填序号)。
①D气体不能用排水法收集
②干燥管里盛有碱石灰
③图②中试管口处的a为棉花团,其作用是防止氨气逸出
(4)气体D催化氧化的化学方程式为 。
(5)物质E的化学式是 ;E在下列物质分类中所属的物质种类是 (填序号)。
①电解质 ②化合物 ③混合物 ④纯净物 ⑤非电解质 ⑥盐
某强酸性溶液X含有Ba2+、Al3+、N 、Fe2+、Fe3+、C
、Fe2+、Fe3+、C 、S
、S 、S
、S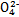 、Cl-、N
、Cl-、N 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是 ;不能确定是否含有的离子是 ,若要确定其中阳离子的存在,最可靠的化学方法是 。
(2)沉淀G的化学式为 。
(3)写出有关离子方程式:
步骤①中生成A 。
步骤②生成沉淀I 。
(4)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)="0.04" mol,而沉淀C物质的量0.07 mol,能说明(1)中不能确定的阴离子存在的理由是 。
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如图所示(图中某些转化步骤及生成物未列出):
请填写下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸气在t℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量。该反应的热化学方程式是 。
(2)上述流程中,工业上分离H2、CO2合理的方法是 。
| A.混合气先通入氢氧化钠溶液,再在溶液中加入盐酸 |
| B.混合气加压冷却,使CO2液化 |
| C.混合气用氨水洗涤 |
| D.混合气先通入石灰浆中,然后高温煅烧固体 |
(3)为了保证顺利合成氨气,在空气进入合成塔之前必须对空气进行 ,目的是 ;在合成氨的实际生产过程中,常采取将生成的氨从混合气体中分离出来,分离出氨的方法: 。
(4)合理地利用资源不仅可以提高经济效益,也是对社会、对全人类负责的表现,请用线段和箭头画出图中的两处合理利用资源情况。
下图是某工厂对海水资源进行综合利用的示意图。
请回答下列问题:
(1)请列举一种海水淡化的方法 。
(2)工业上常用离子交换膜电解槽生产NaOH,电解过程中大量通过离子交换膜的离子是 ,NaOH在电解槽的 室生成,由饱和食盐水制取NaOH的化学方程式为 。
(3)侯氏制碱法中向饱和食盐水中通入CO2和NH3制得NaHCO3,先通入 (填化学式),理由是 。再由NaHCO3制得纯碱,化学方程式为 。
(4)镁是一种用途很广泛的金属材料,目前世界上60%的镁从海水中提取。已知有关物质的熔沸点数据如下:
| MgO |
MgCl2 |
|
| 熔点/℃ |
2 852 |
714 |
| 沸点/℃ |
3 600 |
1 412 |
结合表中数据和实际生产情况说明,工业上生产镁采用电解MgCl2而不是电解MgO的理由 。
合成氨工业、硫酸工业的生产工艺流程大致为:

合成塔和接触室中的反应分别为:
N2(g)+3H2(g) 2NH3(g) ΔH<0; 2SO2(g)+O2(g)
2NH3(g) ΔH<0; 2SO2(g)+O2(g) 2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)写出流程中设备的名称:B ,X 。
(2)进入合成塔和接触室中的气体都要进行热处理,最理想的热处理方法是 。
(3)采用循环操作可提高原料的利用率,下列生产中,采用循环操作的是 (填序号)。
①硫酸工业 ②合成氨工业 ③硝酸工业
(4)工业上常用98.3%的浓硫酸吸收SO3而不用稀硫酸或水的原因是 。
(5)工业生产中常用氨—酸法进行尾气脱硫,以达到消除污染、废物利用的目的。硫酸工业尾气中的SO2经处理可以得到一种化肥,该肥料的化学式是 。
进行污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)~CCl4分离污水中的Cu2+时,先发生络合反应:Cu2++2H2Dz Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
(1)写出双硫腙和Fe3+络合的离子方程式 ,
萃取Fe3+的过程中要控制适宜的酸度,如果溶液的pH过大,其后果是 。
(2)如图是用双硫腙(H2Dz)~CCl4络合萃取某些金属离子的酸度曲线,它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式萃取分离的百分率。
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)~CCl4络合萃取法处理废水。
①欲完全将废水中的Hg2+分离出来,须控制溶液的pH= 。
②当调节pH=2时,铋(Bi)的存在形式有 ,其物质的量之比为 。
③萃取到CCl4中的Zn(HDz)2分液后,加入足量NaOH溶液,充分振荡后,锌又转到水溶液中。写出反应的离子方程式:
(3)污水中的亚汞离子(H )必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化H
)必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化H 生成硫酸汞,写出该反应的化学方程式: 。
生成硫酸汞,写出该反应的化学方程式: 。