(7分)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:
| 物质 |
CO |
H2 |
CH3OH |
| 浓度(mol•L-1) |
0.9 |
1.0 |
0.6 |
①混合气体的平均相对分子质量__________________________。
②列式并计算平衡常数K=__________________________。
③若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是__________。
④若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正___v逆(填“>”、“<”或“=”)。
在锌湿法冶炼过程中,会产生大量铜镉渣(主要含有Zn、Cd、Fe、Cu等),直接丢弃会造成环境污染,也是资源浪费,以下为回收处理铜镉渣制备硫酸锌晶体的工业流程:
已知:硫酸锌晶体易溶于水,难溶于酒精。
(1)加入硫酸的目的。
(2)硫酸不能溶出铜,加入锰粉是为了结合铁离子的变价来传递电子,将铜溶出,锰粉的主要成分为MnO2,相关方程式为2Fe3++Cu=2Fe2++Cu2+和。
(3)由硫酸锌溶液获得硫酸锌晶体,必要的操作方法为。
(4)制得的硫酸锌晶体需要洗涤,选择的试剂为,原因是。
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,
回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑨ |
⑥ |
⑦ |
⑧ |
(1)由①、②两种元素组成的相对分子质量为28的有机物的空间构型是,
该物质与溴水发生加成反应的化学方程式是。
(2)用电子式表示④的简单氢化物的形成过程如下:;
(3) 请设计实验比较元素⑥与⑨金属性的相对强弱:_;
(4) 用①元素的单质与④元素的单质可以制成电池,电池中装有KOH浓溶液,将多孔的惰性电极甲和乙浸入KOH溶液中,在甲极通入①的单质,乙极通入④的单质,则甲极的电极反应式为:。
(5)由表中①、③、④、⑥、⑧元素形成的常见物质X、Y、Z、M、N可发生以下反应: 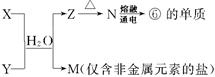
X溶液与Y溶液反应的离子方程式为,工业上常用单质⑥冶炼难熔的金属,写出氧化铁和单质⑥在高温下反应的化学方程式。
Ⅰ.下面列出了几组物质或粒子,请将合适的组号填写在空格上。
①金刚石与“足球烯”(C60);②D与T;③16O、17O和18O;④氧气(O2)与臭氧(O3);⑤乙醇(CH3CH2OH)和甲醚(CH3OCH3);
(1)是同素异形体的, (2)是同位素的,(3)是同分异构体的。
Ⅱ.在下列变化中:①干冰气化 ②硝酸钾熔化 ③食盐溶于水 ④HCl溶于水 ⑤蔗糖溶于水 ⑥HI分解。用序号填空:(1)未破坏化学键的是,(2)仅离子键被破坏的是,
(3)仅共价键被破坏的是。
从海水制备金属镁的流程如图所示: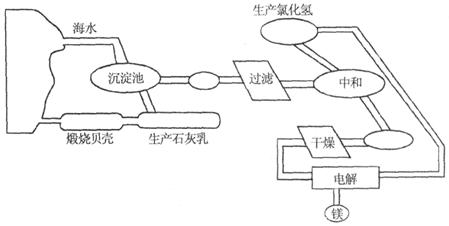
(1)为了节约成本,充分利用海滩资源,用贝壳经过一系列反应可以制得石灰乳,请写出有关反应的化学方程式:__________;__________。
(2)向石灰乳中加入MgCl 溶液,充分搅拌、过滤、洗涤。写出该反应的化学方程式:__________。
溶液,充分搅拌、过滤、洗涤。写出该反应的化学方程式:__________。
(3)从熔点与硬度方面来看,镁合金与镁相比较,其特点有__________。
已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。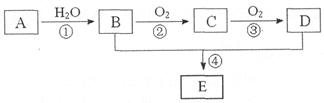
请回答下列问题:
(1)写出A的结构简式__________,B、D分子中的官能团名称分别是__________、__________。
(2)写出下列反应的化学方程式,并注明反应类型:
②____________________,____________________;
④____________________,____________________。
(3)在实验室利用B和D制备E的实验中,若用1mol B和1 mol D充分反应,能否生成1mol E?__________,原因是__________。