科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇:
( CO2 + 3H2 = CH3OH + H2O ),并开发出直接以甲醇为燃料的燃料电池。
已知 H2(g)、 CO(g) 和 CH3OH(l) 的燃烧热△H分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ
(2)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);下列说法正确的是________(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的
平均速率为v(CH3OH)= mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
(3)在T1温度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为 ( 用 a表示 )
(4)已知甲醇燃烧的化学方程式为2CH3OH +3O2 =2CO2 +4H2O ,在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为 ,正极的反应式为
如图所示,甲、乙、丙是三种常见单质,X、Y、Z是它们的化合物。它们之间有如图所示的转化关系。
(1)若甲是具有还原性的金属单质,X、Y、Z中有一种是离子晶体,试推断:
①X、Y、Z中含有丙元素的是(填物质的化学式);
②写出化合物X的电子式;
③X与甲反应的化学方程式是 。
(2)若甲是具有氧化性的黄绿色气体单质,丙通常是深红棕色液体,Y和Z具有相同的阳离子,X与Z含有相同的阴离子。
①写出单质甲的组成元素的原子结构示意图______________;
②实验室贮存丙单质时,通常需要加入,其理由是;
③写出X与足量的甲在溶液中完全反应的离子方程式 ____________________________。
常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸。溶液的Ph值的变化关系如右图所示。
(1) a >7.0的理由是(用离子方程式表示)
(2)如图,当加入稀盐酸的体积为V1mL时,溶液的pH值刚好为7.0。此时溶液中c(Cl-)c(CH3COOH)(填<、>或=)。简要写出判断依据
(3)当加入的盐酸的体积为20.0mL时,测定溶液中的c(H+)为1.3×10-3 mol/L,求CH3COH的电离平衡常数Ka(计算结果保留两位有效数字)。
双酚A,也称BPA,用来生产防碎塑料的原料。欧盟认为含双酚A奶瓶会诱发性早熟,从2011年3月2日起,禁止生产含化学物质双酚A的婴儿奶瓶。
(1)双酚A的结构简式如图Ⅰ所示。写出双酚A的分子式
(2)双酚A由苯酚和丙酮( 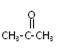 )在酸性介质中反应制得。写出反应的化学方程式
)在酸性介质中反应制得。写出反应的化学方程式
(3)以双酚A和光气(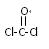 )为原料合成一种防碎塑料——聚碳酸酯,简称PC
)为原料合成一种防碎塑料——聚碳酸酯,简称PC
结构简式如图Ⅱ。以PC为原料制成的婴儿奶瓶在使用过程中会析放出极少量的双酚A,长期使用可能损害婴儿的健康。
①以双酚A和光气合成PC的反应属反应
②写出由PC析放出双酚A的化学方程式
(4)下列关于双酚A和PC的叙述中,正确的是( 双选 )
| A.双酚A分子中所有的碳原子都在同一平面上 |
| B.双酚A和PC都是芳香衍生物 |
| C.一定条件下双酚A和PC都可以和NaOH溶液反应 |
| D.一定条件下1mol PC可以和6mol H2发生加成反应 |
有机物X(C11H9O6Br)分子中有多种官能团,其结构简式为:  (其中Ⅰ、Ⅱ 为未知部分的结构),为推测X的分子结构,进行如下图所示的转化过程:
(其中Ⅰ、Ⅱ 为未知部分的结构),为推测X的分子结构,进行如下图所示的转化过程:
已知向D的水溶液中滴入FeCl3溶液显紫色,滴入NaHCO3溶液有无色无味气体产生,且D苯环上的一氯代物只有两种。
(1)D中含氧官能团名称,B→E的反应类型为;
(2)B和G在一定条件下可反应生成六元环状化合物的化学方程式:;
(3)X可能发生的反应有:(填字母标号)
| A.加成反应 | B.消去反应 | C.取代反应 | D.氧化反应 |
(4)D有多种同分异构体,其中核磁共振氢谱中只有4种峰的同分异构体的结构简式为:(任写两种)。
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH10 (填“>”、“=”或“<”)。
②某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,5min后该反应达到平衡,测得c(CO)= 0.2 mol/L,则用H2表示的该反应的反应速率为:,此时的温度为(从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g)ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l)ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。 
①该电池正极的电极反应为。
② 用该电池电解200mL饱和食盐水(溶质足量),一段时间后,阴极得标况下气体2.24L,电解后溶液的pH为(溶液体积变化忽略不计),要使电解后溶液复原,所加物质为(填名称)。