某化学兴趣小组为探究铜和浓硫酸的反应,用下图装置进行有关实验。请回答:实验中甲同学将a g铜片和12 mL 18mol/L的浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的硫酸和铜片剩余。
(1)请写出铜片和浓硫酸反应的化学方程式
装置E中D内盛品红溶液,当C中气体挤满后,D中有可能观察到的现象是
实验装置D中有可能造成环境污染,试用最简单的方法解决(实验用品自选)
装置B的作用是贮存多余的气体。当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是 B中应放置的液体(填字母)为: 。
A.饱和 Na2SO3 溶液 B.酸性KMnO4 溶液 C.浓溴水 D.饱和NaHSO3
(2)问题讨论:为什么有一定量的余酸但未能使铜完全溶解,你认为原因是 。
足量下列药品能够用来证明反应结束后的烧瓶中却有余酸的是 。
A.Fe粉 B.BaCl2 溶液 C.Ag D. Na2CO3 溶液
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是地壳中含量最高的金属,K是一种红棕色气体。 
请填写下列空白:
(1)组成单质I的元素在周期表中的位置为。
(2)欲检验F溶液中是否含有少量M,可选择的试剂为(填化学式)。
(3)在反应⑦中还原剂与氧化剂的物质的量之比为___________________。
(4)某同学取F的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式:。
(5)将化合物D 与KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾).同时还生成KNO2和H2O 。该反应的化学方程式是__________________________。
(6)镁与I的合金是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、I单质在一定温度下熔炼获得。
①熔炼制备镁I合金时通入氩气的目的是。
②I电池性能优越,I-Ag2O 电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为 。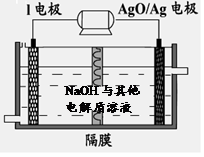
许多含氯物质与生活密切相关,如HC10、C102、NaClO2等都是重要的杀菌消毒剂和漂白剂。下列是重要的含氯漂白剂NaClO2的工业合成流程图。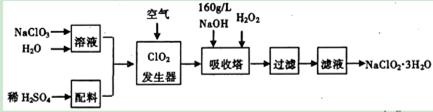
已知:纯ClO2易发生爆炸。请回答下列问题:
(1) 在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是____________。
(2)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中,除用H2O2外,还可以选择的还原剂是______(填代号)。
a.Na2O2 b.Na2S c.FeCl2 d.铁粉
(3)NaClO2溶液与FeCl2溶液相遇,有大量红褐色沉淀产生,该反应的离子方程式为______
(4)为了测定NaClO2 • 3H2O的纯度,取上述合成产品10 g溶于水配成500 mL溶液,取出10 mL溶液于锥形瓶中,再加人足量酸化的KI溶液,充分反应后加人2 ~3滴淀粉溶液,用0.264 mol/L Na2S2O3标准液滴定,锥形瓶中溶液______(填颜色变化),且半分钟内不发生变化,说明滴定达终点,用去标准液20.OOmL,试样纯度是否合格______(填“合格”或“不合格”,合格纯度在90%以上)。提示: 。
。
(一)、某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol.L |
4x10ˉ6 |
6x 10ˉ6 |
2x10ˉ5 |
4x10ˉ5 |
3x10ˉ5 |
2x10ˉ5 |
根据表中数据判断PM2.5为, (填“酸性”、“中性”或“碱性”)
(2)为减少SO2的排放,常采取的措施有:将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g)=H2O(g) 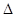 H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g)
H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g)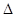 H= -110.5KJ/mol
H= -110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式
(3)洗涤含SO2的烟气,以下物质可作洗涤剂的是(填编号)
a.Ca(OH)2b.Na2CO3c.CaCl2d.NaHSO3
(二)A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。
请回答下列问题:
(1)X的化学式______
(2)下列各项中,能说明元素C比E非金属性强的事实有______(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
④C与E组成化合物,C显负价
(3) 将由BC和BC2组成的混合气体通入下图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。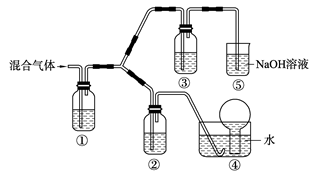
已知(ⅰ)浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC。
(ⅱ)NaOH溶液与BC2反应的化学方程式为:
2NaOH+2BC2=NaBC2+NaBC+H2O
NaOH溶液与BC气体不反应装置②、③中盛放的药品依次是______、______。
(4)通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是______(填一种气体的化学式)。
下表为元素周期表的一部分,其中编号代表对应的元素。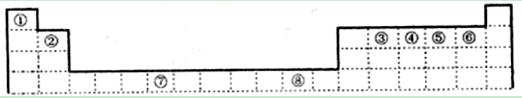
请回答下列问题:
(1)写出元素⑦的基态原子外围电子排布式,元素⑧位于区。
⑤元素原子的价层电子的轨道表示式为 ,
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,该化合物对氢气的相对密度为23,则其中所有杂化原子的杂化方式分别为和。
(3)元素③④⑤⑥的第一电离能由大到小的顺序是 (用元素符号表示)。请写出由④和⑤两种元素形成的与N3ˉ互为等电子体的分子的化学式,
(写出一种即可)其VSEPR构型为。
(一)BaCl2·xH2O中结晶水数目可通过重量法来确定:
①称取1.222g样品,置于小烧杯中,加入适量稀盐酸,加热溶解,边搅拌边滴加稀硫酸到沉淀完全,静置;
②过滤并洗涤沉淀;
③将盛有沉淀的滤纸包烘干并中温灼烧;转入高温炉中,反复灼烧到恒重,称得沉淀质量为1.165g。
回答下列问题:
(1)在操作②中,需要先后用稀硫酸和洗涤沉淀;
(2)计算BaCl2·xH2O中的x=(取整数值)。
(3)操作③中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,这使x的测定结果(填“偏低”、“偏高”或“不变”)。
(二)、图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞
如图B所示。且该物质为自然界最硬的物质。
回答下列问题:
(1)图B对应的物质名称是,(2)d中元素的原子核外电子排布式为。
(3)图A中由二种元素组成的物质中,沸点最高的是,
(4)图A中的双原子分子中,极性最大的分子是。
(5)k的分子式为,