已知①~④均为工业生产及应用的常见反应。其中常温下B、D、J、P气体,E为分子中原子个数比为1∶l的液体。A的相对分子质量为120。M的焰色反应为黄色。(个别反应的产物已略去)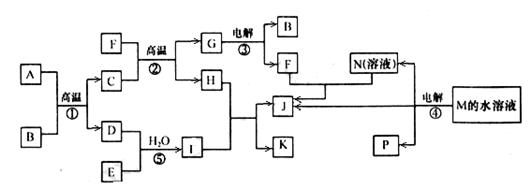
试回答下列问题:
(1) 反应F与N溶液反应的离子方程式为_____________________________________;
(2) 反应⑤中当有1mol电子转移时,氧化剂消耗______ g。
(3) 反应④的离子方程式为______________________________;
下图是该反应原理的示意图,该装置中使用的是______(填“阴”或“阳”)离子交换膜。图中从d处收集到的是______ 。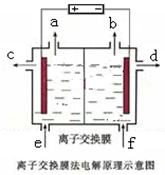
(4) 工业上由D制取I的过程可表示为: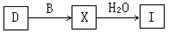
由D与B反应生成X的反应所用的设备是
①高炉 ②沸腾炉 ③接触室 ④分馏塔 ⑤吸收塔
【化学——选修2:化学与技术】(15分)
Ⅰ.合成氨工业的主要反应为:N2(g) + 3H2(g) 2NH3(g) △H<O,下图是合成氨的简要流程示意图:
2NH3(g) △H<O,下图是合成氨的简要流程示意图:
(1)沿X路线进入压缩机的物质是。
(2)氮、氢混合气体送入合成塔前要通过压缩机压缩的原因是;
(3)下图为氨合成塔,为什么原料气从塔底流经外筒环隙进入,气体在反应前后都要通过热交换器?
Ⅱ.氨是一种重要的化工原料,能制备氮肥、硝酸和纯碱等。
(1)我国化学家侯德榜改革国外的纯碱生产工艺,采用联合制碱法,生产流程可简要表示如下:
①写出上述流程中X物质的分子式。
②沉淀池中发生的化学反应方程式是。
③向母液中通入氨气,加入细小食盐颗粒,冷却析出副产品,通入氨气的作用有。
a.增大NH4+的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(2)某工厂用氨制硝酸,再进一步制NH4NO3。已知由NH3制HNO3时产率为88%,由NH3被HNO3的吸收率为98%。则该工厂用100吨氨最多能制硝酸铵吨。
(14分)氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(a、b均大 于0),且已知: 2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-c kJ·mol-1(c>0),请写出CO将NO2还原至N2时的热化学方程式;
(2)图2是实验室在三个不同条件的密闭容器中合成氨时,N2的浓度随时间的变化曲线(以a、b、c表示)。已知三个条件下起始加入浓度均为:c(N2)=0.1mol·L-1, c(H2)=0.3mol·L-1;
合成氨的反应:N2(g)+3H2(g) 2NH3(g)△H< 0
2NH3(g)△H< 0
①计算在a达平衡时H2的转化率为;
②由图2可知,b、c各有一个条件与a不同,则c的条件改变可能是; 试写出判断b与a条件不同的理由;
(3)利用图2中c条件下合成氨(容积固定)。已知化学平衡常数K与温度(T)的关系如 下表:
| T/(K) |
298 |
398 |
498 |
…… |
| K |
4.1×106 |
K1 |
K2 |
…… |
①试确定K1的相对大小,K 1 4.1× 106(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是(填序号字母)。
A.容器内NH3的浓度保持不变B.2υ( N2)正= υ( H2)逆
C.容器内压强保持不变D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性的原因是(用离子反应方程式表示 )。
②25℃时,将pH =x氨水与pH =y的硫酸(且x + y =" 14," x > 11 )等体积混合后,所得溶液中各种离子的浓度关系正确的是
A.c(SO42-)>c(NH4+)>c(H+)>c(OH-) B.c(NH4+)>c(SO42-)>c(OH-)>c(H+)
C.c(NH4+)+c(H+)>c(SO42-)+c(OH-)D.c(NH4+)>c(SO42-)>c(H+)>c(OH-)
硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:
请回答下列问题:
(1)步骤②中发生反应的离子方程式为。
(2)步骤④中调节pH=6.0~6.5的目的是。
(3)对MgSO4·7H2O晶体直接加热(填“能”或“不能”)得到无水MgSO4固体。
(4)步骤⑤的操作为。
(5)长时间加热MgCO3悬浊液后生成Mg(OH)2,该反应的化学方程式为
(6)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH |
< 8.0 |
8.0 ~ 9.6 |
> 9.6 |
| 颜色 |
黄色 |
绿色 |
蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为[25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12]。
(7)药品A是中和胃酸的常用药物,其有效成分是铝和镁的碱式碳酸盐。现进行如下实验确定其化学式:
实验一:取该碱式碳酸盐3.01g充分灼烧至恒重,测得固体质量减少了1.30g;
实验二:另取该碱式碳酸盐3.01g使其溶于足量的盐酸中,产生CO2的体积为112mL(标准状况);
实验三:向实验二的溶液中加入足量的NaOH溶液得到1.74g白色沉淀。
该药品的化学式为。
【化学——选修5:有机化学基础】
化合物H可用以下路线合成: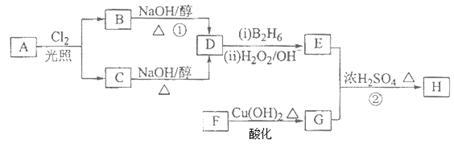
已知:
请回答下列问题:
(1)标准状况下11.2L烃A在氧气中充分燃烧可以生成88gCO2和45gH2O,且A分子结构中有3个甲基,则A的结构简式为;
(2)B和C均为一氯代烃,D的名称(系统命名)为;
(3)在催化剂存在下1molF与2molH2反应,生成3—苯基—1—丙醇。F的结构简式是;
(4)反应①的反应类型是;
(5)反应②的化学方程式为;
(6)写出所有与G具有相同官能团的芳香类同分异构体的结构简式。
【化学——选修3:物质结构与性质】
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的_________区;溴的价电子排布式为____________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_________。
| 氟 |
氯 |
溴 |
碘 |
|
| 第一电离能 (kJ/mol) |
1681 |
1251 |
1140 |
1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图1、2所示: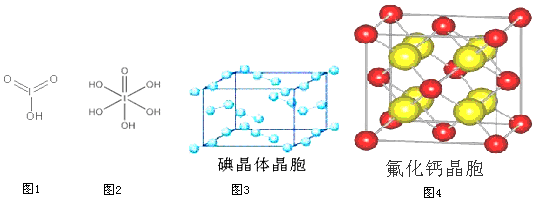
请比较二者酸性强弱:HIO3_____ H5IO6(填“>”、 “<”或“=”)。
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(6)图3为碘晶体晶胞结构。有关说法中正确的是____________。
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(图4)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。