(6分)新制的氯水含有的分子和离子,现分别做如下实验:
将紫色石蕊试液滴入,溶液显红色,起作用的粒子是______________。
上述溶液逐渐褪去,起作用的粒子是__________________________。
加入AgNO3溶液,有不溶于稀硝酸的白色沉淀生成,起作用的粒子是_____。
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氧化钠辖液电解实验,如图所示。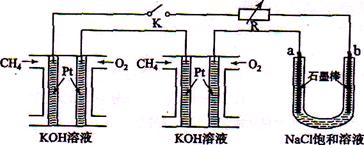
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为、。
(2)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是,电解氯化钠溶液的总反应方程式为;
(3)若每个电池甲烷通如量为1 L(标准状况),且反应完全,则理论上最多能产生的氯气体积为L(标准状况)。
一瓶澄清的溶液,其中可能含有NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、NO3-、I-,取该溶液进行以下实验:
a.用pH试纸测得该溶液呈酸性;
b.取部分溶液,加入数滴新制的氯水及少量CCl4,经振荡、静置后,CCl4层呈紫红色;
c.另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐变为碱性,在整个滴加过程中无沉淀生成;
d.取部分上述碱性溶液,加入Na2CO3溶液,有白色沉淀生成,
e.将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定:
①写出b所发生反应的离子方程式;
②该溶液中肯定存在的离子是;
③该溶液中肯定不存在的离子是。
CCl4和蒸馏水都是无色溶液,请按下列要求用实验方法鉴别:
⑴只允许用一种试剂:用两支试管分别取出少量的CCl4和蒸馏水,然后分别加入少量的单质碘,振荡,呈紫红色的液体是__________,呈棕黄色的液体是__________。
⑵不用任何试剂:用试管取出少量的其中一种液体,再加入另外一种液体,下层液体是__________,上层液体是__________。
某化学兴趣小组对“农夫山泉”矿泉水进行检测时,发现1.0 L该矿泉水中含有45.6 mgMg2+,则Mg2+的物质的量浓度为。
(1).3.6g H2O的物质的量是________,含有___________个水分子,含有________mol H。
(2).12.4gNa2X中含Na+0.4mol,则Na2X的摩尔质量是,X的相对原子质量是。