钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉冶炼,常用赤铁矿、焦炭、空气和熔剂(石灰石)作原料。已知赤铁矿被还原剂还原时是逐级进行的,还原时温度及CO、CO2平衡混合气体中CO的体积分数的关系如下图:
(1)铁在元素周期表中位于 周期 族
(2)在温度低于570℃时,还原分两阶段完成,在温度高于570℃时,依次发生的还原反应有: (选用右图中的a、b、c、d填空)
(3)为减少高炉冶铁时,含CO的尾气排放,下列研究方向不可取的是 。
(a)其它条件不变,增加高炉的高度
(b)调节还原时的炉温
(c)增加原料中焦炭与赤铁矿的比例
(d)将生成的铁水及时移出
(4)已知下列反应数值:
| 反应序号 |
化学反应 |
反应热 |
| ① |
Fe2O3(s)+3CO(g)=2Fe(s)+3CO 2(g) |
△H1= -26.7kJ·mol-1 |
| ② |
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) |
△H2= -50.8kJ·mol-1 |
| ③ |
Fe3O4(s)+CO(g)=3FeO(s)+CO2 (g) |
△H3= -36.5kJ·mol-1 |
| ④ |
FeO(s)+CO(g)=Fe(s)+CO2(g) |
△H4 |
反应④△H4= kJ·mol-1。
(5)1100℃时, FeO(s)+CO(g)  Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2gFeO,同时通入4.48LCO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为: 。
Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2gFeO,同时通入4.48LCO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为: 。
有①甲烷,②乙烷,③丙烷,④丁烷4种烷烃,试回答下列问题:
(1)请写出烷烃在足量的氧气中充分燃烧的化学方程式:
________________________________________________________________________。
(2)相同状况下,等体积的上述气态烃,消耗O2的量最多的是________。
(3)等质量的上述气态烃,在充分燃烧时,消耗O2的量最多的是________。
(4)存在同分异构体的是________。
(5)在120 ℃,1.01×105Pa条件下,某气态烃与足量的O2完全反应后,测得反应前后气体的体积没有发生改变,则该烃为________。
(6)10 mL某气态烃,在50 mL O2中充分燃烧,得到液态水,以及体积为35 mL的混合气体(所有气体体积均在同温同压下测定)。该气态烃是________。
A~G各物质间的关系如下图,其中B、D为气态单质。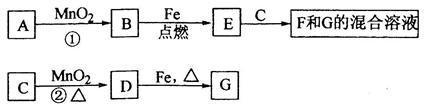
请回答下列问题:
(1)物质C和E的名称分别为________________、__________________;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为_____________;
若只能在加热情况下进行,则反应物A应为_____________;
(3)反应②的化学方程式为_______________________________________;
(4)新配制的F溶液应加入___________以防止其转化为G。检验G溶液中阳离子的常用
试剂是_____________,实验现象为_________________________________________。
Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大。W、X与Y同周期,Y与Z同主族。Q与W可以按照原子个数比4∶1形成化合物甲,且甲分子中含有10个电子。Q与X形成化合物乙,乙可与Z的最高价氧化物的水化物按照物质的量之比2∶1反应形成盐丙。(1)甲的电子式是______________。
(2)Q和Y形成的既含极性键又含非极性键的共价化合物的化学式是________。
(3)向少量丙溶液中加入浓Ba(OH)2溶液至过量并加热,反应的离子方程式是________________________。
聚苯乙烯可用于制备高频绝缘材料,苯乙烯在一定条件下存在如下图转化关系。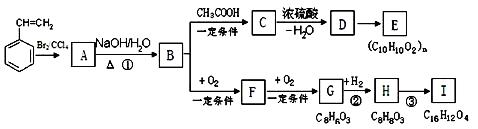
请回答下列问题:
(1)由苯乙烯合成这种高聚物的化学方程式为。
(2)反应①的反应类型是,C→D的反应类型是。
(3)C可能的结构简式有。
(4)H有多种同分异构体。同时符合下列条件的同分异构体共有种。
a. 与FeCl3溶液发生显色反应 b. 1 mol H最多能与3 mol NaOH反应;
c. 苯环上只有两个取代基。
(5)反应③的化学方程式是,I的核磁共振氢谱里有个吸收峰。
Q 、X、Y、Z、W是元素周期表前四周期中的五种常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| Q |
只有一种能级,其电子总数等于能层序数 |
| X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z |
Z和Y同周期,Z的电负性大于Y |
| W |
W的一种核素的质量数为63,中子数为34 |
(1)Y位于元素周期表第 周期表 族,Y和Z的最高价氧化物对应的水化物的酸性较强的是 (写化学式)。
(2)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(3)W的基态原子核外电子排布式是 。在W的晶体结构里,配位数是;
(4)Q、X形成的最简单化合物里中心原子的杂化类型是,其空间结构为,Q与氧原子形成的化合物里中心原子杂化类型与上述物质相同,但键角不同,其原因可能是;
(5)写出与YO2互为等电子体的一种单质的分子式是。