进行化学实验,观测实验现象,通过分析推理得出正确的结论是学习化学的方法之一。对下列实验事实的解释正确的是
| A.在KI淀粉溶液中通入Cl2,溶液变蓝,说明氯气能与淀粉发生显色反应 |
| B.浓硝酸在光照条件下变黄,说明浓硝酸不稳定,有有色产物生成且能溶于浓硝酸 |
| C.在某溶液中加入HNO3酸化的BaCl2溶液有白色沉淀产生,说明溶液中含有SO42- |
| D.将铜片放入浓硫酸中无明显实验现象,说明铜在冷的浓硫酸中发生钝化 |
将 转变为
转变为 的方法为()
的方法为()
| A.与足量的NaOH溶液共热后,再通入CO2 |
| B.溶液加热,通入足量的HCl |
| C.与稀H2SO4共热后,加入足量的Na2CO3溶液 |
| D.与稀H2SO4共热后,加入足量的NaOH溶液 |
下图是某只含有C、H、O、N的有机物简易球棍模型,下列关于该有机物的说法正确的是()
A.分子式为C3H7NO
B.在一定条件下,可以通过聚合反应,生成高分子化合物
C.不能和盐酸溶液反应
D.不能和NaHCO3溶液反应生成CO2
可用来鉴别苯酚溶液、乙酸乙酯、乙苯、庚烯的一组试剂是()
| A.银氨溶液、溴水 | B.酸性高锰酸钾溶液、氯化铁溶液 |
| C.酸性高锰酸钾溶液、溴水 | D.氯化铁溶液、溴水 |
下列实验可达到实验目的的是()
| A.将苯与浓硝酸、浓硫酸的混合物在60℃水浴加热条件下反应可生成硝基苯 |
| B.用酸性高锰酸钾溶液即可检验CH2=CH-CHO中的碳碳双键 |
C.将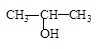 与NaOH的醇溶液共热制备CH3—CH═CH2 与NaOH的醇溶液共热制备CH3—CH═CH2 |
| D.淀粉在硫酸催化作用下水解,将银氨溶液加入到水解后的溶液中可检验淀粉水解的产物葡萄糖 |
下列各组中的反应,属于同一反应类型的是()
| A.乙烯水化制乙醇;溴乙烷水解制乙醇 |
| B.甲苯使酸性高锰酸钾溶液褪色;丙炔使溴的四氯化碳溶液褪色 |
| C.乙醇脱水制乙烯;溴乙烷与NaOH乙醇溶液共热制乙烯 |
| D.苯的硝化;苯与氢气(镍作催化剂)制取环己烷 |