溶液在生产和生活中有重要意义。
(1)氯化钠溶液中溶质是 ;硝酸钾溶液中的溶剂是 。
(2)某兴趣小组为了研究物质的溶解和结晶,做了如下所述过程的实验: 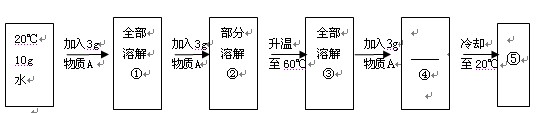
小资料:氯化钠和硝酸钾的溶解度数值:
| 项目 |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
70℃ |
| NaCl |
35.8g |
36.0g |
36.3g |
36.6g |
37.0g |
37.3g |
37.8g |
| KNO3 |
20.9g |
31.6g |
45.8g |
63.9g |
85.5g |
110g |
138g |
①物质A是 (填“氯化钠”或“硝酸钾”)
②状态“④”时,物质A 溶解(填“部分”或“全部”)
③上述实验过程中所得溶液达到饱和的是_______(填数字序号,下同);溶质质量分数最大的是 。
氧气、水、二氧化碳是我们身边重要的化学物质。
(1)氧气可以用于气焊气割的原因是。
(2)水是一种很好的溶剂。下列几种家用清洁剂都是用水做溶剂配制而成的,其功能及有效成分如下表所示。
| 清洁剂名称 |
洁厕灵 |
活氧彩漂 |
漂白精 |
| 功能 |
有效清除污垢,除异味 |
漂洗衣物,使色彩更鲜艳 |
快速漂除衣物污渍 |
| 有效成分 |
HCl |
H2O2 |
NaClO |
据表回答下列问题:
① NaClO中氯元素的化合价为。
② 在盛有少量“活氧彩漂”液体的试管中,加少量二氧化锰,观察到的现象是。
③ “洁厕灵”与“漂白精”不能混用。二者若混合易产生有毒的氯气,同时有氯化钠和水生成,该反应的化学方程式为。
(3)“低碳生活”有望成为新的时尚流行全球。“低碳生活”是指生活中耗用少的能量,从而降低碳特别是二氧化碳的排放。下列生活方式符合“低碳生活”并可行的(填数字序号)。
①将呼吸产生的二氧化碳用石灰水吸收
②少开私家车,多乘坐公共交通工具出行
③广泛使用一次性筷子、一次性塑料袋
④用电邮、QQ等即时通讯工具,少用传真及打印机
“民以食为天”。了解食物的特性,正确选购食品,科学配置一日三餐,对于提高生活质量,增进身体健康是非常重要的。
(1) 下面为三类营养物质及其对生命活动的意义。
糖类构成细胞的基本物质
蛋白质调节新陈代谢、维持身体健康
维生素为机体活动提供能量
①请将上述营养物质与它们相对应的“对生命活动的意义”连接起来。
②图片C中米饭等食品中所含的主要营养素是_______________。
A水果B蛋、肉等 C米饭等食品
③有些青少年由于摄入维生素不足而引起生长发育迟缓,你建议应多吃上述食物中___。
(2)豆浆已成为众多家庭的早餐必备饮品,下表是豆浆中一些成分的平均含量:
| 成分 |
水 |
蛋白质 |
脂肪 |
糖类 |
钙 |
磷 |
铁 |
维生素A |
| 含量(%) |
96.0 |
1.8 |
0.7 |
1.1 |
0.01 |
0.03 |
0.0005 |
0.015 |
①豆浆中含有种人体必须的营养素,人体缺少表中元素会引起贫血。
②摄入适量维生素A可以预防眼部疾病,维生素A包括A1和A2两种分子,其化学式分别为C20H30O或C20H28O,维生素A1和A2的相同,不同。
)化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下列实验装置图回答问题: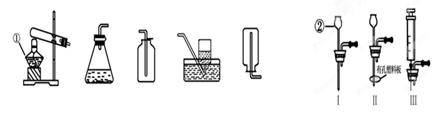
A B C DE
图1图2
(1)写出图中带标号仪器的名称:① ② 。
(2)若实验室对你开放,请从图1中选择合适的装置,制取一种你熟悉的气体。你想制取的气体是 ,选择的发生装置是 (填序号,下同),选择的收集装置是 ,选择此收集装置的理由是 。在连接你选择的气体发生装置与收集装置时,使玻璃导管较易插入橡胶导管的措施是 。
(3)装置B虽然操作简便,但无法控制反应速率。请从图2中选取 (填序号)取代B中的单孔塞,以达到控制反应速率的目的。
正确的操作能保证实验顺利进行。请填写下列有关实验操作中的空格:
(1)用酒精灯给物质加热时,要用酒精灯火焰的_______________;
(2)点燃可燃性气体时,都要先______________________,再点燃;
(3)做细铁丝在氧气中燃烧的实验时,集气瓶底应预先________________________;
(4)用量筒量取液体度数时,视线与液体凹液面的最低处的位置关系是___________(填写“俯视”、“仰视”或“保持水平”,下同)。如果采取_______位置关系,则量取的液体体积大于实际值。
(5)实验室中制取氧气并用排水法收集,实验结束时,要先,然后。
元素周期表是学习和研究化学的重要工具。下表是元素周期表中的一部分,请按表中信息填空:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
O |
| 2 |
3 Li 锂 6.941 |
4 Be 铍9.012 |
5 B硼10.81 |
6 C碳12.01 |
7 N氮14.01 |
8 O氧16.00 |
9 F 氟19.00 |
10Ne氖20.18 |
| 3 |
11Na钠22.99 |
12Mg镁24.31 |
13 Al铝26.98 |
14 Si硅28.09 |
15 P磷30.97 |
16 S硫32.06 |
17 Cl氯35.45 |
18 Ar氩39.95 |
(1)查找出原子序数为10的元素名称,其相对原子质量。第3周期,ⅢA的元素符号是_______。
(2)硫元素的原子结构示意图为 该元素的原子核外有个电子层,它属于元素(填“金属”、“非金属”)。
该元素的原子核外有个电子层,它属于元素(填“金属”、“非金属”)。