物质丙是重要的化工产品,在国民经济中占有重要地位。工业上用甲和乙合成丙。甲、乙、丙的微观示意图见下表。
| 物质 |
甲 |
乙 |
丙 |

|
||||
| 微观示意图 |
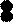 |
 |
 |
(1)甲、乙、丙三种物质都是由(填“分子”、“原子”或“离子”) 构成的。
(2)甲、乙、丙中属于化合物的是(填序号) 。
(3)已知物质丙中氢元素的化合价为+1,则另一种元素的化合价为 。
(4)甲和乙合成丙的反应中,甲、乙、丙的微粒个数比为 。
(5)现有10 g的甲和60 g的乙混合反应制取丙,反应一段时间后,经测定剩余甲的质量为4 g,则剩余乙的质量为 g
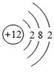
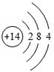
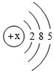
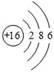
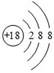
下表为元素周期表中某一周期元素的原子结构示意图。请回答下列问题:
(1)表中磷原子的核电荷数X=_________;
(2)表中具有相对稳定结构的元素是;
(3)在化学反应中,每个铝原子失去________个电子形成铝离子;
(4)表中元素在周期表中处于第周期,它们属于同一周期的原因是。
| 元素名称 |
钠 |
镁 |
铝 |
硅 |
磷 |
硫 |
氯 |
氩 |
| 元素符合 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
| 原子结构示意图 |
 |
 |
 |
 |
 |
 |
 |
 |
有六种气体:①氧气 ②氢气 ③二氧化硫 ④一氧化碳 ⑤二氧化碳 ⑥甲烷
请选择填空:
(1)形成酸雨的主要成分是(填序号,下同);
(2)可用来制汽水的是;
(3)将成为一种重要的无污染新型燃料的是;
(4)在冶金工业利用其还原性用于炼铁的是;
(5)能与人体血液中血红蛋白结合的有毒气体是;
(6)充分燃烧时生成两种氧化物的是_________。
(11分) 根据下面实验装置图,按要求回答有关问题:
(1)写出图中带有标号仪器的名称:a ;b ;
(2)在实验室中用氯酸钾制取氧气时,所发生的化学反应方程式为 ;
用带火星的木条检验氧气时,可观察到的现象是;
(3)实验室制取二氧化碳气体,应选择的发生装置为(填写装置的字母代号,下
同);应选用的收集装置是。如果选用C收集,则二氧化碳与水发生反应,反
应的化学方程式为;
(4)下列是初中化学部分重要的实验或实验装置。
①A实验如果实验数据小于21%,可能原因是(写出一点);
②B实验蜡烛火焰熄灭说明二氧化碳具有的性质是。
人类的日常生产、生活都离不开水。
(1)化学课上同学们分组研究水的净化及组成(装置如图)。其中一组同学用自制简易净水器(图①所示)净化池塘水,其中活性炭的作用是,净化后的池塘水与矿泉水、蒸馏水、自来水四种水中属于纯净物的是_________;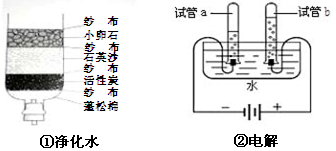
(2)实验②中通电一段时间后,试管b中产生的气体是(写化学式),该实验说明水是由组成的,该反应的方程式是;
(3)检验水是硬水还是软水,可用的物质是;生活中使硬水软化的一种常用方法是;
(4)下列生活中的做法不利于节约用水的是(多选)。
| A.洗菜的水用来浇花 | B.未喝完的矿泉水随手倒掉 |
| C.用不间断的流水冲洗碗筷 | D.洗手使用洗手液时暂时关闭水龙头 |
在“宏观—微观—符号”之间建立联系,是化学学科特有的思维方式。如果用“●”表示氢原子,用“○”表示氧原子,用 表示氯原子,用“
表示氯原子,用“ ”表示氯气分子,如图为A、B两种物质反应的微观过程(恰好完全反应),请你根据图示回答下列问题:
”表示氯气分子,如图为A、B两种物质反应的微观过程(恰好完全反应),请你根据图示回答下列问题:
(1)请用给定的符号,在B方框内画出相应数量的B分子模型;
(2)已知D物质的化学式为HClO,写出该微观过程表示的化学反应方程式:
。