在一定温度下,可逆反应A(g) + 3B(g) 2C(g)达到平衡的标志是
2C(g)达到平衡的标志是
A、C生成的速率和C分解的速率相等
B、A、B、C的浓度相等
C、单位时间内生成n摩A,同时生成3n摩B
D、A、B、C的分子数之比为1:3:2
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是
| A.放电时负极反应为:3Zn -6e-+6OH-=3Zn(OH)2 |
| B.放电时正极反应为:2FeO42-+6e-+8H2O=2Fe(OH)3+10OH- |
| C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化 |
| D.放电时正极附近溶液的碱性减弱 |
化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是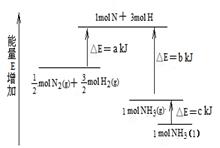
| A.N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-1 |
| B.N2(g)+3H2(g)=2NH3(g); △H=2(b-a)kJ·mol-1 |
C. N2(g)+ N2(g)+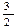 H2(g)=NH3(1); △H=(b+c-a)kJ·mol-1 H2(g)=NH3(1); △H=(b+c-a)kJ·mol-1 |
D.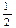 N2(g)+ N2(g)+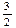 H2(g)=NH3(g); △H=(a+b)kJ·mol-1 H2(g)=NH3(g); △H=(a+b)kJ·mol-1 |
下列实验能达到预期目的的是
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
②将Cl2的制备和性质实验联合进行以减少实验中的空气污染
③用食醋和澄清石灰水验证蛋壳中含有碳酸盐
④用硝酸钡溶液鉴别硫酸根离子与亚硫酸根离子
⑤用溴水检验汽油中是否含有不饱和脂肪烃
| A.①②③ | B.①③④ | C.②③⑤ | D.②④⑤ |
向含有0.2 mol氢氧化钠和0.1 mol氢氧化钙的溶液中,持续稳定地通入二氧化碳气体,通入气体为6.72 L(标准状况)时,立即停止,则这一过程中,溶液中离子数目与通入二氧化碳气体体积的关系正确的是(不考虑气体的溶解)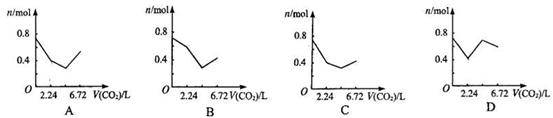
已知氧化还原反应: 2Cu(IO3)2 + 24KI + 12H2SO4 =" 2CuI↓" + 13I2 + 12K2SO4 + 12H2O其中1mol氧化剂在反应中得到的电子为
| A.10mol | B.11mol | C.12mol | D.13mol |