下列说法中正确的是
| A.凡是放热反应都是自发的,吸热反应都是非自发的 |
| B.自发反应在恰当条件下才能实现 |
| C.高温高压下使石墨转化为金刚石的反应是自发的化学反应 |
| D.同一物质的固、液、气三种状态的熵值相同 |
某溶液中只含有Na+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为
| A.1∶2 | B.1∶4 | C.3∶4 | D.3∶2 |
下列离子方程式中书写正确的是
| A.铁和稀硫酸反应:2Fe+6H+===2Fe3++3H2↑ |
| B.碳酸钙和稀盐酸反应:CaCO3+2H+===Ca2++CO2↑+H2O |
| C.铜和硝酸银溶液反应:Cu+Ag+===Cu2++Ag |
| D.硫酸镁溶液与氢氧化钡溶液反应:Mg2++2OH-===Mg(OH)2↓ |
下列各组离子不能大量共存的是
| A.Cl-、Na+、NO3-、OH- | B.HCO3-、Cl-、Na+、K+ |
| C.Ba2+、Cl-、SO42-、K+ | D.NH4+、K+、NO3-、Cl- |
下列反应属于氧化还原反应的是
| A.CaCO3+2HCl=CaCl2+CO2↑+ H2O | B.CaO+H2O=Ca(OH)2 |
C.2H2O2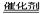 2H2O+O2↑ 2H2O+O2↑ |
D.CaCO3 CaO+CO2↑ CaO+CO2↑ |
下列说法正确的是
| A.氧化还原反应的本质是电子的转移 |
| B.化合反应一定是氧化还原反应 |
| C.物质中某元素失去电子,则此物质是氧化剂 |
| D.离子反应可能是复分解反应,但一定不是氧化还原反应 |