医药阿斯匹林的结构简式如图1所示:
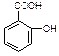
图1 图2
试根据阿斯匹林的结构回答;
⑴阿斯匹林看成酯类物质,口服后,在胃肠酶的作用下,阿斯匹林发生水解反应,生成A和B 两种物质。其中A的结构简式如图2所示,则B的结构简式为 ;B中含有的官能团名称是 。
⑵阿斯匹林跟NaHCO3同时服用,可使上述水解产物A与NaHCO3反应,生成可溶性盐随尿液排出,此可溶性盐的结构简式是 。
⑶上述水解产物A与氢氧化钠溶液反应的化学方程式为
;
有些盐的结晶水合物,白天在温度不太高时就能熔化(实质是溶于自身的结晶水中),同时吸收热量;在晚上又可缓慢凝固而释放热量,用以调节室温,称为潜热材料。现有几种盐的水合晶体有关数据如下:
| Na2S2O3·5H2O |
CaCl2·6H2O |
Na2SO4·10H2O |
Na2HPO4·12H2O |
|
| 熔点(℃) |
40.50 |
29.92 |
32.38 |
35.1 |
| 熔化热(kJ/mol) |
49.7 |
37.3 |
77 |
100.1 |
⑴上述四种水合晶体盐中最适宜用做潜热材料的两种盐是(用化学式表示)
;。
(2)实际应用时最常采用的(由来源和成本考虑)应该是。
2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。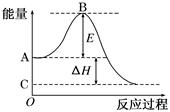
已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。请回答下列问题:
⑴图中A点表示:_____;C点表示:(填“反应物的总能量”“生成物的总能量”)
⑵E的大小对该反应的反应热________(填“有”或“无”)影响。
⑶图中ΔH=________kJ/mol。
已知化合物A、D、E、G焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以治疗胃酸过多。A~H各物质的变化关系如下图所示。
写出各步反应的化学方程式
反应①
反应②
反应③
反应④
反应⑤
按要求完成下列除杂问题
(1)FeCl2溶液中混有少量FeCl3,除杂试剂为,
离子方程式;
(2)FeCl3溶液中混有少量FeCl2,除杂试剂为,
离子方程式;
(3)Fe2O3中混有Al2O3,除杂试剂为,
离子方程式。
(10分)已知A为常见的金属单质,根据下图所示的关系: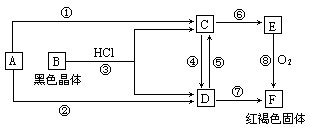
(1)确定A、B的化学式,A为 __________,B为 ___________。
(2)C和D可相互转化,描述C→D溶液的颜色变化:____________________。
④的离子方程式:_____________________________________________________。
⑤的离子方程式:_____________________________________________________。
(3)由E→F的实验现象为:___________________________________。