在某温度下合成氨:N2+3H2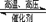 2NH3(△H<0),把N2和H2以1︰1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器容积固定),在保持同温度下,A、B两个容器的合成氨反应先后达到平衡状态。请回答:
2NH3(△H<0),把N2和H2以1︰1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器容积固定),在保持同温度下,A、B两个容器的合成氨反应先后达到平衡状态。请回答:
(1)写出该反应的平衡常数表达式:_____________,KA______KB(填“>”、“<”或“=”)。
(2)平衡常数K值越大,表明建立平衡时__________。
A.N2的转化率越低 B.NH3的产量越小
C.正反应进行得越彻底
(3)欲增大该反应K值,可以采取的措施为__________。
A.升高温度 B.降低温度
C.增大N2、H2的浓度 D.使用高效的催化剂
(4)分析下表中数据后,完成下列问题[M(平)表示平衡时混合物的平均相对分子质量:达平衡时,容器A中N2的转化率为___________,容器B中M(平)为__________,容器______(填“A”或“B”)中,NH3的物质的量所占的比例较大。
| |
容器A |
容器B |
| M(平) |
20 |
|
| 平衡时N2的转化率 |
|
10%[来 |
【物质结构与性质】
以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点。回答下列问题:
(1)镓为元素周期表第31号元素,镓原子价层电子排布图为___________。
(2)氮所在主族中第一电离能最大的元素是________(填元素符号,下同),镓所在主族中电负性最大的元素是____________________。
(3)传统的氮化镓制备方法是采用GaCl3与NH3在一定条件下反应,该反应的化学方程式为______________。
(4)氮化镓与金刚石具有相似的晶体结构,氮化镓中氮原子与镓原子之间以____相结合,氮化镓属于_______晶体。
(5)下图是氮化镓的晶胞模型:
①氮化镓中镓原子的杂化方式为__________,氮原子的配位数为___________。
②氮化镓为立方晶胞,氮化镓的密度为d g/cm3。列出计算氮化镓晶胞边长a的表达式:a=_______cm。
磺基琥珀酸酯盐表面活性剂产品合成所用的原料主要为顺丁烯二酸酐、脂肪醇的衍生物以及亚硫酸氢盐等。产品合成可分为酯(酰)化和磺化两步: (1) 顺酐与羟基化合物酯化 ( 缩合 ) ,(2) 这些酯与亚硫酸氢盐进行加成得到磺化产物。其反应原理如图①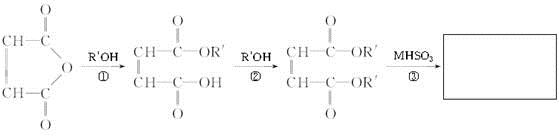
,
顺丁烯二酸酐 马来酸双酯 磺基琥珀酸双酯盐
(1)反应①属于________(取代、加成)反应。
(2)马来酸双酯分子中官能团的名称为________。
(3)已知反应③为加成反应,H原子加到一个不饱和碳原子上,剩余原子团加到另外一个不饱和碳原子上,磺基琥珀酸双酯盐的结构简式为________。
下面是由A经过下列步骤可以合成顺丁烯二酸酐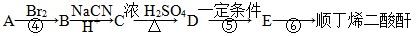
已知: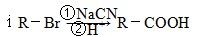
ⅱ丁二酸酐中α碳原子有较强的活泼性,能发生卤代反应
ⅲ反应⑤、⑥的反应条件都不会破坏D中的官能团(注:此项仅为解题服务,与实际是否相符,不予考虑)
(4)写出反应⑤的化学方程式 ________________________________________。
(5)反应⑥的反应条件是____________、________。
(6)写出满足下列条件的D的一种同分异构体的结构简式__________________。
a.核磁共振氢谱中只有两个峰,且峰面积相等;b.分子中无环状结构
一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。工业上依此用CO生产燃料甲醇。
CH3OH(g)。工业上依此用CO生产燃料甲醇。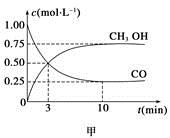
(1)甲图是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用H2浓度变化表示平均反应速率v(CO)=__________________。
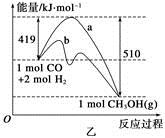
(2)乙图表示该反应进行过程中能量的变化。曲线b下的反应条件为。该反应的焓变是________(填“ΔH<0”或“ΔH>0”),写出反应的热化学方程式;选择适宜的催化剂______(填“能”或“不能”)改变该反应的反应热。
(3)该反应平衡常数K的表达式为______________________,温度升高,平衡常数K________(填“增大”、“不变”或“减小”)。
(4)恒容条件下,下列措施中能使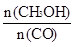 增大的有____________。
增大的有____________。
a.降低温度b.充入He气
c.再充入1molCO和2molH2d.使用催化剂
【有机物化学基础】
对羟基苯甲醛,俗称PHBA,是-种重要的有机化工原料。其结构如图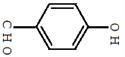 所示。有人提出,以对甲基苯酚为原料合成PHBA的途径如下:
所示。有人提出,以对甲基苯酚为原料合成PHBA的途径如下: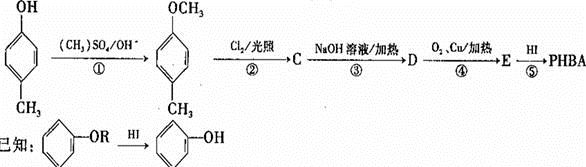
(1)PHBA的官能团的名称为_______。
(2)下有关PHBA的说法正确的是_______。
| A.PHBA的分子式为C7H6O2 |
| B.PHBA是一种芳香烃 |
| C.1mol PHBA最多能与4mo1 H2反应 |
| D.PHBA能与NaHCO3溶液反应生成CO2 |
(3)上述反应中属于取代反应的_______。
(4)反应③的化学方程式为_______。
(5)该合成途径中的反应①⑤的作用为_______。
(6)E有多种同分异构体,符合以下所有特征的同分异构体的结构简式为______ (只写一种)。
a.苯环上存在2种不同化学环境的氢原子,且个数比为1:2
b.遇FeCl3溶液显示特征颜色
c.能使溴的四氯化碳溶液褪色
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入
和
,电解质为
溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。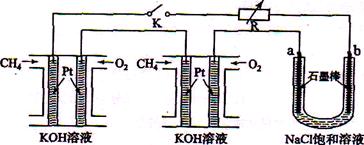
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为、。
(2)闭合
开关后,
、
电极上均有气体产生.其中
电极上得到的是,电解氯化钠溶液的总反应方程式为;
(3)若每个电池甲烷通入量为1
(标准状况),且反应完全,则理论上通过电解池的电量为(法拉第常数
=9.65×l04
.
,列式计算),最多能产生的氯气体积为
(标准状况)。