以食盐为原料进行生产并综合利用的某些过程如下图所示。
(1)除去粗盐中的Ca2+、Mg2+和SO 离子,加入下列沉淀剂的顺序是(填序号) 。
离子,加入下列沉淀剂的顺序是(填序号) 。
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是 。
(3)电解饱和食盐水反应的离子方程式是 。
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是 。
(5)纯碱在生产生活中有广泛的应用。
①纯碱可用于除灶台油污。其原因是(结合离子方程式表述) 。
②常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13。
则反应前的溶液中与反应后的滤液中水电离出的c(OH—)的比值是 。
③工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是 。(已知碳酸的酸性强于次氯酸)。
已知下列数据:
下图为实验室制取乙酸乙酯的装置图。
(1)当饱和碳酸钠溶液上方收集到较多液体时,停止加热,取下小试管B,充分振荡,静置。振荡前后的实验现象_________(填选项)。
| A.上层液体变薄 | B.下层液体红色变浅或变为无色 |
| C.有气体产生 | D.有果香味 |
(2)为分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行分离: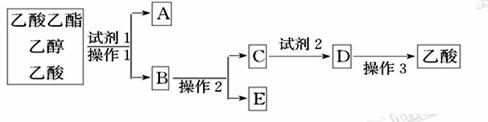
①试剂1最好选用___________;
②操作1是_____,所用的主要仪器名称是________;
③试剂2最好选用___________;
④操作2是___________;
⑤操作3中温度计水银球的位置应为如下图中______(填a、b、c、d)所示,在该操作中,除蒸馏烧瓶、温度计外,还需要的玻璃仪器有_______、_______、_______、______,收集乙酸的适宜温度是___________。
某学生用0.1 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
| A.移取20 mL待测盐酸注入洁净的锥形瓶,并加入2~3滴酚酞 |
| B.用标准溶液润洗滴定管2~3次 |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2 cm |
E.调节液面至“0”或“0”以下刻度,记下读数
F.在锥形瓶下垫一张白纸,把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)_____________________________ ______;
(2)操作中锥形瓶下垫一张白纸的作用是___________________________________________;
(3)判断到达滴定终点的实验现象是_________________________________ ____;
(10分)经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
(1) 定性分析:如图甲可通过观察____________________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________________________________________________________,
写出H2O2在二氧化锰作用下发生反应的化学方程式
____________________________________________________________________。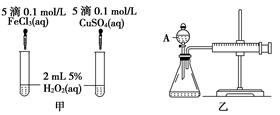
(2) 定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是___________________________________________________________。
检查乙装置气密性的方法是
____________________________________________________________________。
(3) 0.6 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,发生如下反应:
2X(g)+Y(g)===nZ(g)+2W(g), 2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的反应速率为0.1 mol/(L·min),则前2 min内,用X的物质的量浓度变化表示的平均反应速率为________;2 min末时Y的物质的量浓度为________;化学方程式中,Z的化学计量数n=________。
(4) 在一定温度下,反应:2A(s)+2B(g) 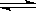 C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是________
C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是________
| A.容器内的压强不随时间而变化 |
| B.混合气的密度不再随时间而变化 |
| C.A的质量不再改变 |
| D.平衡混合气体的平均相对分子质量不再改变 |
某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
【提出猜想】 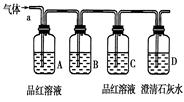
猜想1:______________________________,
猜想2:______________________________,
猜想3:______________________________。
为了验证猜想,该小组设计实验加以探究:
【实验探究】
该小组同学按如图所示装置,将气体从a端通入,则:
(1) B中可以装下列________试剂(填编号)。
| A.NaCl溶液 | B.KMnO4溶液 |
| C.盐酸 | D.澄清石灰水 E.NaHCO3 溶液 F.碘水 |
(2) A中品红溶液的作用是:_________________________________。
(3) D中澄清石灰水的作用是:_________________________________。
通过该实验,该小组同学观察到以下三个实验现象:
①A中品红溶液褪色 ②C中品红溶液不褪色③D中澄清石灰水变浑浊
【得出结论】
(4) 由上述现象该小组同学确认该气体的成分为:______________________。
(5) 请写出SO2与氯水发生反应的离子方程式:_________________________。
(本小题满分14分)某研究性学习小组欲验证红热的炭与浓硫酸发生反应所生成的各种产物,按气体的流动方向设计了如下实验流程:
(1)①中反应的化学方程式为 ;
(2)②处的现象是: 。
(3)品红溶液使用了两次,第一次使用时的作用是
第二次使用时的作用是________________ _。
(4)二氧化硫也能使溴水褪色,表现了二氧化硫的 性。(“还原”、“漂白”)
反应的化学方程式为: 。
(5)根据 现象,可证明产物中一定有CO2气体