某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
【提出猜想】 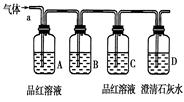
猜想1:______________________________,
猜想2:______________________________,
猜想3:______________________________。
为了验证猜想,该小组设计实验加以探究:
【实验探究】
该小组同学按如图所示装置,将气体从a端通入,则:
(1) B中可以装下列________试剂(填编号)。
| A.NaCl溶液 | B.KMnO4溶液 |
| C.盐酸 | D.澄清石灰水 E.NaHCO3 溶液 F.碘水 |
(2) A中品红溶液的作用是:_________________________________。
(3) D中澄清石灰水的作用是:_________________________________。
通过该实验,该小组同学观察到以下三个实验现象:
①A中品红溶液褪色 ②C中品红溶液不褪色 ③D中澄清石灰水变浑浊
【得出结论】
(4) 由上述现象该小组同学确认该气体的成分为:______________________。
(5) 请写出SO2与氯水发生反应的离子方程式:_________________________。
某消毒液的主要有效成分是次氯酸钠,可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品。本消毒液须密封,置阴凉暗处保存。请完成以下实验探究过程:
(1)推测该消毒液的酸碱性:__________,原因是(用离子方程式表示)__________________。
(2)该消毒液还具有的化学性质是________性、________性和_________性。
(3)若将一定量的消毒液与Na2SO3溶液相混合,得到混合液。混合时发生的离子方程式为:______________。
基于该反应,对反应后混合液进行探究。
提出合理假设:
假设1:Na2SO3有剩余;
假设2:NaClO有剩余;
假设3:__________________。
设计后续实验方案验证假设。请在答题卡上写出实验步骤以及预期现象和结论。 限选实验试剂:
3mol/L 盐酸、3mol/L H2SO4、0. 01 mol/L KMnO4、0. 1 mol/L BaCl2、20% KSCN、3% H2O2、淀粉-KI溶液、紫色石蕊溶液。
| 实验步骤 |
预期现象和结论 |
| 步骤1:将上述混合液分置于A、B试管中。 |
|
| 步骤2: |
|
| 步骤3: |
某校课外小组模拟工业制备纯碱并测定纯碱的纯度,甲、乙两组同学分别进行了下列相关实验。
(1)已知碳酸氢钠受热分解生成碳酸钠、水和CO2,由碳酸氢钠制备纯碱的过程中用到的主要仪器除酒精灯、泥三角、三脚架、玻璃棒外,还有__________________。
(2)甲组同学利用以下装置制备碳酸氢钠: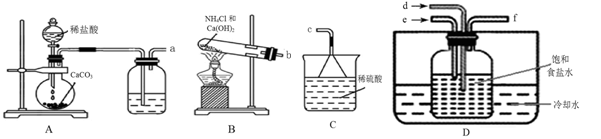
①图中装置的连接方法为a接 ,b接 ,f接c。
②装置D中试剂瓶内发生的化学反应方程式为 。
③实验中要求通入的NH3过量之后再通入CO2气体,检验通入的NH3已过量的实验操作是 。
(3)已知实验中得到的Na2CO3中常含有少量NaCl。乙组设计如下图所示装置来测定Na2CO3的含量。
①检验装置F气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后静置,若 ,说明装置不漏气。
②装置E中的试剂 ,装置G的作用 。
③以上实验装置存在明显缺陷,该缺陷导致测定结果偏高,该缺陷为 。
下列有关实验操作与相应结论都正确的是
(15分)铁、铜等金属及其化合物在日常生产生活中用途非常广泛。
Ⅰ.实验室欲制备0.3 mol Cu (NO3)2晶体,甲、乙两同学分别设计实验方案如下:
甲:Cu Cu(NO3)2
Cu(NO3)2
乙:Cu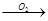 CuO
CuO Cu(NO3)2
Cu(NO3)2
(1)从绿色化学的角度分析,同学的方案更合理。
(2)乙同学实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,宜选择装置(填字母序号)。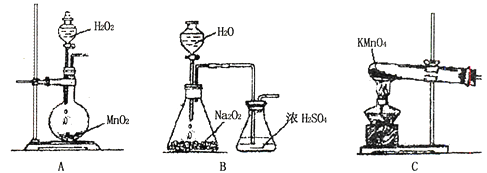
Ⅱ.某化学实验小组通过实验来探究一包黑色粉是否由Fe3O4、CuO组成
探究过程如下:
(1)提出假设:假设1. 黑色粉末是CuO;
假设2. 黑色粉末是Fe3O4;
假设3. 黑色粉末是CuO和Fe3O4的混合物。
(2)设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
①若假设1成立,则实验现象是溶液显蓝色。
②若假设2或3成立,则实验现象是。
为进一步探究,继续向所得溶液加入足量铁粉,若产生的现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。
查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。
为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生现象;若假设3成立,则产生现象。
III.由Fe3O4、FeO、CuO、Fe组成的固体混合物,在加热条件下用足量的CO还原,得到金属混合物2.86g,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00g白色沉淀。固体混合物的质量是。
某学习小组用下图装置测定镁铝合金中铝的质量分数和铝的相对原子质量。
(1)A中试剂为______________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是____。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥,称重;
③待B中不再有气体产生并恢复至室温后,记录C的液面位置;
④由A向B中滴加足量试剂。
上述操作的顺序是___________(填序号);在进行操作③时记录C的液面位置时,除视线平视外,还应_。
(4)B中发生反应的化学方程式为___________________。
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为_______________。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________(填“偏大”、“偏小”、“无影响”)。