阅读下列实验内容,根据题目要求回答问题。
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00 mL待测硫酸配制100 mL稀H2SO4溶液;以0.14 mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00 mL,滴定终止时消耗NaOH溶液15.00mL。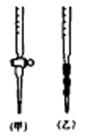
(1)该学生用标准0.14 mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
| A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂。 |
| B.用待测定的溶液润洗酸式滴定管。 |
| C.用蒸馏水洗干净滴定管。 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2—3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下。 |
E.检查滴定管是否漏水。
F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写) 。
②该滴定操作中应选用的指示剂是 。
③在G操作中如何确定终点?
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“无影响”) 。
(3)用标准NaOH溶液滴定时,应将标准NaOH溶液注入滴定管 (选填“甲”或“乙”)中。
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定
值 (选填“偏大”“偏小”或“无影响”)
(5)计算待测硫酸溶液的物质的量浓度(计算结果精确到小数点后二位) mol·L-1(2分)。
某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4。溶液中得到蓝色沉淀。关于沉淀的成分,有以下几种假设:
假设1:沉淀是CuCO3;
假设2:沉淀是Cu(OH)2;
假设3:沉淀是_____________________________________。
(1)若假设1成立,则发生反应的离子方程式为_______________________________。
(2)若假设2成立,原因是__________________________________________________。
(3)该研究性学习小组拟用以下装置测定沉淀成分,请完成下表。已知:①CuCO3和Cu(OH)2均不带结晶水;②装置气密性良好;③原装置中的空气对实验结果的影响可忽略。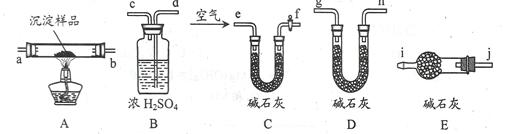
| 实验步骤 |
预期现象 |
结论 |
| ①称量B、D的质量分别为ml、m2,将装置按 f→a→b→___→___→___→___→j→i顺序连接。 |
||
| ②称取一定质量的沉淀______________________,然后___________________,冷却后再称量B、D的质量分别为m3、 m4 |
(1)若m1 = m3,m2 < m4 (2)若m1___m3,m2___m4 (3)若ml___m3,m2___m4 |
(1)假设1成立 (2)假设2成立 (3)假设3成立 |
(4)若沉淀样品的质量为w克,装置B质量增加了x克,则沉淀中Cu(OH)2的质量分数为__________________________。[已知Cu(OH)2的式量为98]
根据镁与二氧化碳的反应推测,钠也能在二氧化碳中燃烧,且固体产物可能为碳酸钠、氧化钠、碳中的两种或三种。某兴趣小组对钠在二氧化碳中燃烧后的产物进行定性和定量探究。
(1)假设产物为Na2CO3、Na2O和C的混合物,设计实验方案,验证其中的Na2CO3和Na2O。在答题卡上写出实验步骤、预期现象和结论。(已知室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、BaCl2溶液、Ba(OH)2溶液、精密pH试纸(精确至0.1)、烧杯、试管、滴管、玻璃棒、表面皿、比色卡
| 实验操作 |
预期现象和结论 |
| 步骤1:取适量产物样品于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,取上层清液备用。 |
有不溶的黑色固体。 |
| 步骤2:取适量步骤1清液于试管中, |
|
| 步骤3: |
(2)假设产物为Na2CO3、Na2O和C的混合物,为进一步测定产物中Na2CO3的含量,进行了以下实验:
步骤1:准确称取w克试样,溶解、过滤后准确配制成250mL溶液。
步骤2:准确量取25.00mL所配溶液于锥形瓶中,滴加几滴指示剂A,滴加c mol/L的标准盐酸至溶液的pH约为8.2(碳的主要存在形式为HCO3―),消耗盐酸的体积为V1mL;再滴加几滴甲基橙,继续用上述盐酸滴至溶液由黄色变橙色,消耗盐酸的体积为V2mL。
步骤3:重复实验3次。滴定结果如下
| 滴定 次数 |
待测溶液 的体积/mL |
消耗标准盐酸的体积 |
|
| V1/mL |
V2/mL |
||
| 1 |
25.00 |
15.02 |
4.97 |
| 2 |
25.00 |
14.98 |
5.03 |
| 3 |
25.00 |
13.21 |
6.75 |
①步骤2中,第一步滴定所使用的A指示剂为,滴定终点的现象为。
②计算Na2CO3的质量分数=(用含w、c的代数式表示)
工业上用异丙苯氧化法合成苯酚,其生产流程如下图: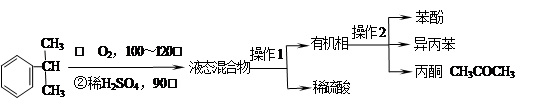
有关物质的性质如下表:
| 物质 |
沸点 |
溶解性 |
主要化学性质 |
| 异丙苯 |
152.4℃ |
不溶于水,易溶于酒精。 |
可被强氧化剂氧化 |
| 苯酚 |
181.8℃ |
微溶于冷水,易溶于热水和酒精等有机溶剂。 |
易被氧化 |
| 丙酮 |
56.2℃ |
易溶于水和有机溶剂 |
不易被氧化 |
(1)检验有机相中是否含有水的方法是;
(2)“操作2”的名称是;
(3)丙酮中常含有苯酚和异丙苯中的一种或者两种有机物杂质,某同学做了如下检验。
| 检验项目 |
实验方案 |
| 检验丙酮中一定存在有机杂质的方法是 |
A.酸性KMnO4溶液,加热 B.乙醇,溶解 C.NaOH溶液(酚酞),加热 |
| 检验丙酮中一定含有苯酚的方案是: |
取少许待测液置于试管中,滴加1~2滴FeCl3溶液。预期的实验现象和结论是。 |
(4)某同学对该厂废水进行定量分析。取20.00mL废水于锥形瓶中,水浴加热,用0.1000mol·L-1酸性KMnO4溶液滴定(假定只有苯酚与KMnO4反应)。达到滴定终点时,消耗KMnO4溶液的体积为10.00mL。有关反应方程式为:
5 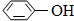 + 28KMnO4 + 42H2SO4
+ 28KMnO4 + 42H2SO4 28MnSO4 + 14K2SO4 + 30CO2↑+ 57H2O
28MnSO4 + 14K2SO4 + 30CO2↑+ 57H2O
①滴定终点的现象为。
②该废水中苯酚的含量为mg·mL-1。(保留二位有效数字)。
实验室需要纯净的NaCl溶液,但实验室的NaCl晶体混有少量Na2SO4和NH4HCO3,某同学按如下流程图设计实验除去杂质,回答下列问题: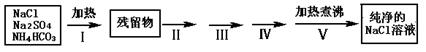
(1)步骤I除去的杂质是(填化学式)_______________,直接加热要好于加强碱后再进行加热,理由是;
(2)按流程图完成实验设计,将相关的实验操作、实验现象和实验目的填写在下表中:
| 操作步骤 |
实验现象 |
实验目的 |
| 步骤II:将残留物溶解得到溶液, |
||
| 步骤III: |
 |
|
| 步骤IV:过滤,往滤液中 |
||
| 步骤V:将溶液加热煮沸 |
 |
(3)若最后得到20℃的NaCl饱和溶液。已知20℃时NaCl的溶解度为36.0g、NaCl饱和溶液的密度为1.12g/cm3 ,则20℃的NaCl饱和溶液的物质的量浓度为mol/L(计算结果保留三位有效数字)。
某化学兴趣小组在学习“硫酸盐的某些性质和用途”中,进行了如下实验探究:
【实验一】检验(NH4)2Fe(SO4)2·6H2O溶液中含有的阳离子。
(1)在下表中写出操作步骤和实验现象:
限选试剂:新制氯水、1mol/LH2SO4溶液、0.1mol/L KSCN溶液、NaOH浓溶液、浓盐酸、1mol/LNa2CO3溶液
| 操 作 步 骤 |
实验现象 |
结 论 |
| 步骤I:取少量待检液于试管中, 。 |
溶液中含有Fe2+ |
|
| 步骤II:取少量待检液于试管中, 。 |
溶液中含有NH4+ |
【实验二】用KHSO4制取H2O2并测其质量分数:
查阅资料得知:工业上用电解KHSO4饱和溶液可制取一定浓度的H2O2。兴趣小组进行下列实验测定H2O2的质量分数。已知:2MnO4-+5H2O2+6H+= 2Mn2++8H2O+5O2↑
操作①:取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
操作②:用0.1000 mol/L KMnO4溶液滴定;
操作③:用同样方法滴定,四次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL、22.00 mL。
回答下列问题:
(2)操作②中,开始滴入KMnO4溶液时反应速率很慢,随着KMnO4溶液滴入反应速率显著加快,最有可能的原因______________________。
(3)滴定时盛装KMnO4溶液应选取的仪器是(填序号)。
A.50mL酸式滴定管 B.50mL碱式滴定管
C.25mL酸式滴定管 D.25mL碱式滴定管
(4)在上述实验中,下列操作会造成测定结果偏高的有(填序号)。
A.锥形瓶用待测液润洗
B.量取 H2O2溶液的滴定管用蒸馏水洗净,未用H2O2溶液润洗
C.滴定速度过快,又未摇匀,停止滴定后发现紫红色褪去
D.滴定前读数时平视,滴定终点读数时仰视
(5)分析数据,计算H2O2溶液中溶质的质量百分含量为___________(保留三位有效数字)。