工业上用异丙苯氧化法合成苯酚,其生产流程如下图: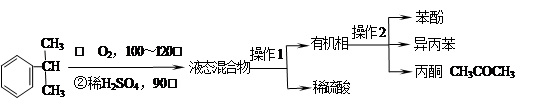
有关物质的性质如下表:
| 物质 |
沸点 |
溶解性 |
主要化学性质 |
| 异丙苯 |
152.4℃ |
不溶于水,易溶于酒精。 |
可被强氧化剂氧化 |
| 苯酚 |
181.8℃ |
微溶于冷水,易溶于热水和酒精等有机溶剂。 |
易被氧化 |
| 丙酮 |
56.2℃ |
易溶于水和有机溶剂 |
不易被氧化 |
(1)检验有机相中是否含有水的方法是 ;
(2)“操作2”的名称是 ;
(3)丙酮中常含有苯酚和异丙苯中的一种或者两种有机物杂质,某同学做了如下检验。
| 检验项目 |
实验方案 |
| 检验丙酮中一定存在有机杂质的方法是 |
A.酸性KMnO4溶液,加热 B.乙醇,溶解 C.NaOH溶液(酚酞),加热 |
| 检验丙酮中一定含有苯酚的方案是: |
取少许待测液置于试管中,滴加1~2滴FeCl3溶液。预期的实验现象和结论是 。 |
(4)某同学对该厂废水进行定量分析。取20.00mL废水于锥形瓶中,水浴加热,用0.1000mol·L-1酸性KMnO4溶液滴定(假定只有苯酚与KMnO4反应)。达到滴定终点时,消耗KMnO4溶液的体积为10.00mL。有关反应方程式为:
5 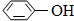 + 28KMnO4 + 42H2SO4
+ 28KMnO4 + 42H2SO4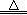 28MnSO4 + 14K2SO4 + 30CO2↑+ 57H2O
28MnSO4 + 14K2SO4 + 30CO2↑+ 57H2O
①滴定终点的现象为 。
②该废水中苯酚的含量为 mg·mL-1。(保留二位有效数字)。
(10分)乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下: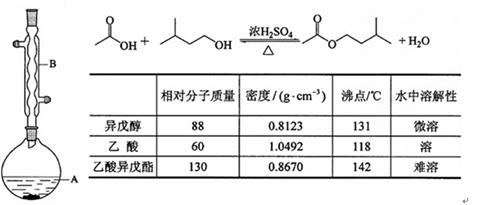
实验步骤:
在A中加入4.4 g的异戊醇、6.0 g的乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的名称是。
(2)在洗涤操作中,第一次水洗的主要目的是,第二次水洗的主要目的是。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是。
(5)实验中加入少量无水MgSO4的目的是。
(6)在蒸馏操作中,仪器选择及安装都正确的是(填标号)。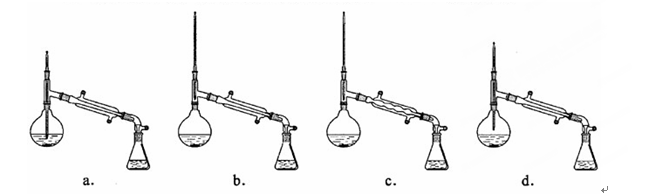 (7)本实验的产率是(填标号)。
(7)本实验的产率是(填标号)。
a.30℅b.40℅ c.60℅ d.90℅
(8)在进行蒸馏操作时,若从130 ℃便开始收集馏分,会使实验的产率偏(填“高”或“低”), 原因是。
我国制碱工业的先驱——侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:NH3+C02+NaCl+H20=NH4CI+NaHCO3(晶体),依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。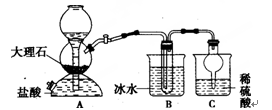
(1)A装置中所发生反应的离子方程式为。
C装置中稀硫酸的作用为。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g水);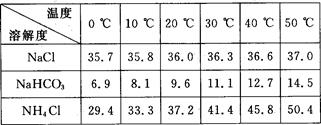
参照表中数据,请分析B装置中使用冰水的目的是。
(3)该校学生在检查完此套装置的气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出
应在装置之间(填写字母)连接一个盛有的洗气装置,其作用。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85 g,实验后得到干燥的NaHCO3晶体的质量为5.04 g,则NaHCO3的产率为。
无水AlCl3是一种重要的有机合成催化剂,该物质在183℃时升华,遇潮湿空气即产生大量白雾。某中学化学兴趣小组拟利用中学常见仪器设计实验制备无水AlCl3,实验装置如下图所示。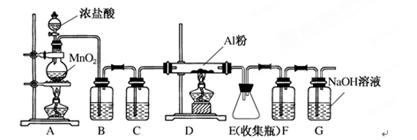
请回答下列问题:
(1)制备实验开始时,先检查装置的气密性,接下来的操作依次是________。
a.加入MnO2粉末 b.点燃A中酒精灯 c.加入浓盐酸 d.点燃D处酒精灯
(2)写出A装置中发生反应的离子方程式___________________________________。
(3)装置B中的试剂是__________。该装置存在安全隐患,请指出。
(4)甲同学认为F和G可以用一种仪器替代,且加入一种药品即可达到相同效果。这种药品可以是____。
(5)E中得到少量白色粉末,打开软木塞后可明显观察到锥形瓶中有白雾生成,用化学方程式表示其原因____________________________________________。
某化学活动小组设计以下装置进行不同的实验。其中a为用于鼓入空气的气囊,b为螺旋状铜丝,c中盛有冰水。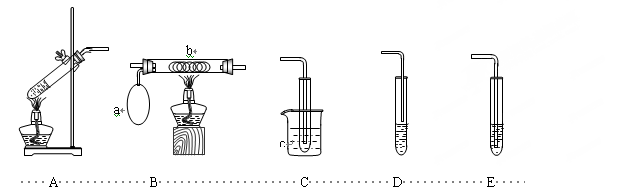
(1)若用A装置做乙醇与乙酸的酯化反应实验,则还需连接的装置是(填序号),该装置中应加入试剂。从实验安全角度考虑,A装置试管中除加入反应液外,还需加入的固体物质是。A中反应的化学方程式为:。
(2)该小组同学欲做乙醇氧化成乙醛的实验并收集生成的产物,则应选用的装置是(填序号),反应的化学方程式为______________________________________。
(3)若再用制得的乙醛溶液进行银镜反应,选用2%的AgNO3溶液和2%的稀氨水配制银氨溶液的操作是。
某校化学小组为探究铁与浓硫酸反应是否生成SO2,设计了以下装置进行实验。
(1)写出铁与浓硫酸反应的化学方程式;
若在取用浓硫酸的过程中,不慎在皮肤上沾少量浓硫酸,处理的方法是。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境;二是。
(3)品红溶液的作用是。
(4)小组讨论后认为:由于常用的铁丝是铁碳合金,生成的气体中还可能含有CO2。写出生成CO2的化学方程式。