某校化学小组为探究铁与浓硫酸反应是否生成SO2,设计了以下装置进行实验。
(1)写出铁与浓硫酸反应的化学方程式 ;
若在取用浓硫酸的过程中,不慎在皮肤上沾少量浓硫酸,处理的方法是 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境;二是 。
(3)品红溶液的作用是 。
(4)小组讨论后认为:由于常用的铁丝是铁碳合金,生成的气体中还可能含有CO2。写出生成CO2的化学方程式 。
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验: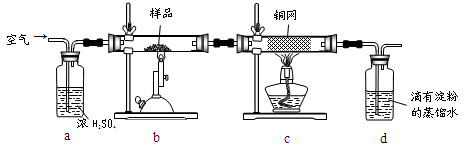
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题:
(1)称量样品所用的仪器为_____(填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是_______。
(2)装置a和c的作用分别是____和____(填标号)。
| A.除去SO2气体 | B.除去空气中的水蒸气 | C.有利于气体混合 |
| D.有利于观察空气流速 E.除去反应后多余的氧气 |
(3)上述反应结束后,仍需通一段时间的空气,其目的是___________。
(4)通过计算可知,该黄铜矿的纯度为________。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是____(填序号)。
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有_____________________________________________。
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是;
A.品红溶液B.紫色石蕊溶液 C.酸性KMnO4溶液D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为:;
(3)过程③中,需加入的物质是;
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有;
(5)过程⑤调节pH可选用下列试剂中的(填选项序号);
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一80℃,目的是;
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.700g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为。(假设杂质中不含铁元素和硫元素)。
氨基甲酸铵是一种用途广泛的化工原料。有关它的资料如下:①常温下,在干燥的空气中稳定,遇水或潮湿空气则生成碳酸铵或碳酸氢铵;②熔点58℃,59℃则可分解成NH3和CO2气体;③在密封管内加热至120℃~140℃时失水生成尿素[CO(NH2)2];④酸性溶液中迅速分解;⑤合成氨基甲酸铵原理为:
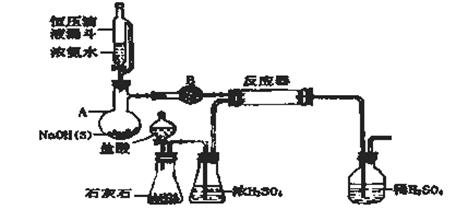
(1)写出氨基甲酸铵在密封管内加热至120°C~140°C生成尿素的反应方程式:_______________
(2)仪器B名称________;盛放药品是: ________;
(3)合成氨基甲酸铵的反应在一定条件下能自发进行,该反应的反应热ΔH_____0(填“>” “=”或“<”)
(4)有同学建议该CO2发生装置直接改用“干冰”,你认为他的改进有何优点:(回答二点)
①________________;②________________
(5)该实验装置中有明显导致实验失败的隐患有:(指出主要二处)
①________________;②________________
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钻矿(主要成分为CO2O3、Co
(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
已知:①浸出液含有的阳离了主要有H+、CO2+、Fe2+、Mn2+、Al3+等:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01 mo1·L-l)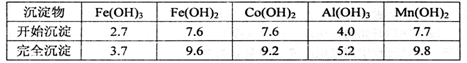
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式。
(2)写出NaC1O3发生反应的主要离子方程式;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式。
(3)“加Na2CO3调pH至a'’,过滤所得到的沉淀成分为____。
(4)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是:其使用的最佳pH范围是____。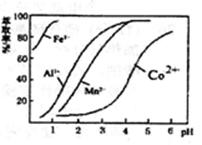
| A.2.0~2.5 | B.3.0~3.5 | C.4.0~4.5 | D.5.0~5.5 |
(5)“操作l”中包含3个基本实验操作,它们依次是、和过滤。制得的CoC12·6H2O在烘干时需减压烘干的原因是。
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是。(答一条即可)
硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”。它易溶于水,难溶于乙醇,加热易分解。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:实验具体操作步骤为: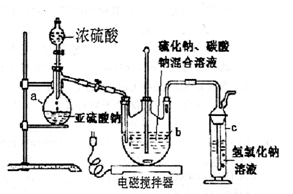
①开启分液漏斗,使硫酸慢慢滴下,适当调节螺旋夹,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电磁搅拌器搅动。
②至析出的硫不再消失,控制溶液的pH接近
7时,停止通入SO2气体。
③抽滤所得的滤液,转移至蒸发皿中,水浴加热
浓缩,直到溶液表面出现晶膜。
④冷却结晶、抽滤、洗涤。
⑤将晶体放入烘箱中,在40~45℃左右干燥
50~60min,称量。
请回答以下问题:
(l)仪器a的名称是;
(2)步骤②中若控制pH值小于7,则产率会下降,请用离子方程式解释原因:。
(3)步骤③中不能将溶液蒸发至干的原因是;晶膜通常在溶液表面出现的原因是。
(4)步骤④中洗涤硫代硫酸钠晶体所用试剂的结构式是。
(5)为检验制得的产品的纯度,该实验小组称取5,0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.0lmol·L-1 KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O =2I-+S4O
=2I-+S4O ,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
| 实验序号 |
1 |
2 |
3 |
| Na2S2O3溶液体积(mL) |
19.98 |
20.02 |
21.18 |
则该产品的纯度是____,间接碘量法滴定过程中可能造成实验结果偏低的是____。
A.滴定管末用Na2S2O3溶液润洗 B.滴定终点时仰视读数
C.锥形瓶用蒸馏水润洗D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡