氨在工农业生产中应用广泛。在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:
| 温度/°C |
200 |
300 |
400 |
500 |
600 |
| 氨含量/% |
89.9 |
71.0 |
47.0 |
26.4 |
13.8 |
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是 。
(2)根据-4,合成氨的热化学方程式是 。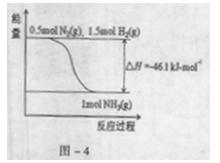
(3)在一定温度下,将2molN2和6molH2通入到体积为1L的密闭容器中,发生反应
N2+3H2  2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)= ;该温度下的平衡常数K= (用分数表示);俗使K增大,可以采取的措施是 。
2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)= ;该温度下的平衡常数K= (用分数表示);俗使K增大,可以采取的措施是 。
(4)从化学平衡移动的角度分析,提高H2转化率可以采取的措施是 (选填序号字母)
a.及时分离出NH3 b.升高温度
c.增大压强 d.使用催化剂
某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H =-49.0 kJ·mol-1 测得CH3OH的物质的量随时间变化如图所示,回答问题:
CH3OH(g)+H2O(g) △H =-49.0 kJ·mol-1 测得CH3OH的物质的量随时间变化如图所示,回答问题: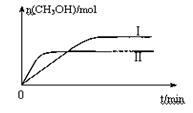
①该反应的平衡常数表达式为K=。
②曲线I、Ⅱ对应的平衡常数大小关系为KⅠKⅡ(填“大于”、“等于”或“小于”)。
③其它条件不变时,下列措施能提高H2转化率的是(填字母)。
| A.减小CO2的浓度 | B.降低温度 | C.增加H2的浓度 | D.增大压强 |
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(I)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s) + 3C(石墨) =2Fe(s) + 3CO(g) △H 1 =+489 kJ·mol-1
C(石墨) +CO2 (g) =2CO(g) △H 2 = +172 kJ·mol-1
则Fe2O3(s) + 3CO(g) = 2Fe (s) + 3CO2(g) △H=。
②利用燃烧反应可设计成CO/O2燃料电池(以H2SO4溶液为 电解质溶液),写出该电池的正极反式。
(II)如图所示,烧杯中都盛有稀硫酸。
(1)中反应的离子方程式为;比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是(用序号表示) 。
溶液配制是中学化学实验的基本操作。
(1)用氢氧化钠固体配制100 mL 1.0mol·L-1氢氧化钠溶液时,需要用到的玻璃仪器有玻璃棒、胶头滴管、烧杯、量筒和 ________________________________。
(2)配制一定物质的量浓度溶液时用到的仪器较多,下列有关叙述正确的是_____。
a.称量NaOH固体时,分别在天平的两个托盘垫上相同大小的纸片
b.玻璃棒的作用是搅拌、引流
c.用浓硫酸配制稀溶液时,在量筒中稀释后要冷却至室温再转移到容量瓶中
d.容量瓶在使用前要检查是否漏水
(3)实验室配制一定物质的量浓度硫酸溶液,在用量筒量取浓硫酸时俯视读数,结果配制出的硫酸溶液浓度将会________。(填偏大、偏小或无影响)
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Fe3+、SO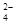 、NO
、NO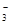 、CO
、CO 、Cl
、Cl 。某同学收集了该地区的雾霾,经必要的预处理后获得试样溶液,设计并完成了如下的实验:
。某同学收集了该地区的雾霾,经必要的预处理后获得试样溶液,设计并完成了如下的实验: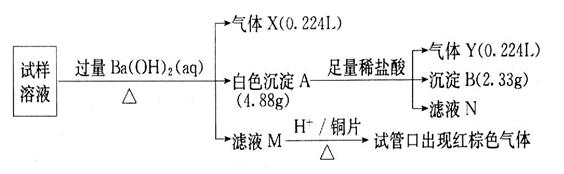
回答下列问题:(注明:白色沉淀A4.88g改为4.30g)
(1)检验气体X通常使用的试剂是______________________;
(2)沉淀B是_________,在沉淀A中加入足量稀盐酸后,溶解的沉淀是_________;
(3)试样中肯定不存在的离子是___________,不能确定是否存在的离子是______;
(4)滤液M在酸性条件下与铜片的反应中,还原产物是________________________。
(5)将实验中得到的气体Y全部通入10mL1.2mol·L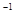 的氢氧化钠溶液中,所得溶液中含有阴离子主要有________________________________________。
的氢氧化钠溶液中,所得溶液中含有阴离子主要有________________________________________。
铁是人类较早使用的金属之一。运用铁及其化合物的有关知识,同答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是________。(填序号)
a.纯铁硬度比生铁高
b.纯铁耐腐蚀性强,不易生锈
c.不锈钢是铁合金,只含金属元素
d.铁在一定条件下,可与水蒸气反应
e.铁在冷的浓硫酸中钝化
(2)向沸水中逐滴滴加1mol L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为_____________,所形成该分散系的微粒范围是__________。
L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为_____________,所形成该分散系的微粒范围是__________。
(3)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路极。请写出FeCl3溶液与铜反应的离子方程式___________。
(4)高铁酸钠(Na2FeO4)是一种新型净水剂。
①高铁酸钠在水中可以发生如下反应:4FeO4 +10H2O=4Fe(OH)3+8OH
+10H2O=4Fe(OH)3+8OH +3O2。由此看来,高铁酸钠能够杀菌消毒是因为它具有____________性,而能够除去水中悬浮物是因为__________。
+3O2。由此看来,高铁酸钠能够杀菌消毒是因为它具有____________性,而能够除去水中悬浮物是因为__________。
②下列物质能用作净水剂的有___________。
a.KAl(SO4)2 l2H2O b.聚合硫酸铁
l2H2O b.聚合硫酸铁
c.ClO2 d.“84”消毒液