实验室制取乙酸丁酯的实验装置有以下甲、乙两种装置可供选用。

(甲) (乙)
制备乙酸丁酯所涉及的有关物质的物理性质见下表
| |
乙酸 |
1-丁醇 |
乙酸丁酯 |
| 熔点(℃) |
16.6 |
-89.5 |
-73.5 |
| 沸点(℃) |
117.9 |
117 |
126.3 |
| 密度(g/cm3) |
1.05 |
0.81 |
0.88 |
| 水溶性 |
互溶 |
可溶 (9g/100g水) |
微溶 |
(1)制取乙酸丁酯的装置应选用___________(填“甲”或“乙”)。不选另一种装置的
理由是______________________________________________________________。
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式)________________________________________________________________。
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,写出两种可行的方法:
①___________________________________________________________________,
②___________ ________________________________________________________。
________________________________________________________。
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是________________(选填答案编号)。

A B C D
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须_______
______________________,某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有 。
化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。请回答:
(1)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种气体的成分是(填化学式),这种黑色物质继续与浓硫酸作用,产生两种气体的化学方程式为:。
(2)根据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有(填序号)。
| A.酸性 | B.吸水性 | C.脱水性 | D.强氧化性 |
(3)将实验(2)产生的刺激性气味的气体通入氯水中,可以看到氯水褪色,说明这种气体具有性;请写出该反应的化学方程式:。
某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇为主要原料制备环己烯.
已知:
| 密度(g/cm3) |
熔点(℃) |
沸点(℃) |
熔点(℃) |
|
| 环乙醇 |
0.96 |
25 |
161 |
难溶于水 |
| 环乙烯 |
0.81 |
﹣103 |
83 |
难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是,导管B除了导气外还具有的作用是.
②试管C置于冰水浴中的目的是.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在层(填上或下),分液后用(填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按图2装置蒸馏,冷却水从口进入(填“g”或“f”).收集产品时,控制的温度应在左右,实验制得的环己烯精品质量低于理论产量,可能的原因是.
为了证明稀硝酸与铜反应的气体产物是NO,某同学设计了如下实验装置和实验方案。
实验步骤:
(1)关闭K1,打开K2,向试管中加石灰石,通过分液漏斗向其中加入一定的稀硝酸,则加入石灰石的作用是________________________________,反应化学方程式是。
(2)将将铜丝插入稀硝酸中,微热大试管。该步反应离子方程式是。
(3)充分反应后,打开开关K1,通过气囊鼓入空气,可以观察到烧瓶中,证明稀硝酸与铜反应的气体产物是NO。
(4)NaOH溶液的作用。
溴苯是一种常用的化工原料,通常以苯和溴为原料制取,查资料知:
| 苯 |
溴 |
溴苯 |
|
| 密度/g·cm-3 |
0.88 |
3.10 |
1.50 |
| 沸点/℃ |
80 |
59 |
156 |
| 在水中的溶解度 |
微溶 |
微溶 |
微溶 |
实验室制备溴苯的实验步骤如下:
步骤1:在a中加入15 mL苯和少量铁屑,再将b中4.0 mL液溴慢慢加入到a中。
步骤2:充分反应后,向a中加入10 mL水,然后过滤除去未反应的铁屑。
步骤3:滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL 水洗涤,分液得粗溴苯。
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品。
(1)步骤1仪器a中发生的主要化学反应方程式为:。
(2)仪器c的作用是冷凝回流,回流的主要物质有:。
(3)步骤3中NaOH所发生的主要反应是: 。
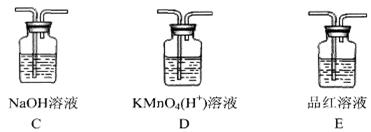
(4)若将图1虚线框部分改为图2装置,则 D、E可以检验出来的物质是,其中试管C中苯的作用是,能否据此判断发生了取代反应?(填“是”或“否”)。
某化学小组同学欲在实验室中用乙醇制备1,2-二溴乙烷。
甲同学设计的实验装置如下图:
(1)请写出A和B中发生的主要反应的化学方程式:
A中:________________________________________。
B中:________________________________________。
(2)乙同学查阅资料得知:
①此反应可能存在的主要副反应有:在浓硫酸的存在下,乙醇可发生如下反应生成乙醚,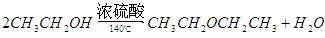
②乙醚不与溴水反应
有关数据列表如下:
| 乙醇 |
1,2-二溴乙烷 |
乙醚 |
|
| 颜色、状态 |
无色液体 |
无色液体 |
无色液体 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
若最终产物中混有少量乙醚,可用__________的方法除去。
(3)丙同学观察到:在实验后期A中液体变黑,认为应该在装置A和B之间加入装置__________(填序号),此装置的作用是___________________。