一定条件下,在体积为10 L的密闭容器 中,1 mol X和1 mol Y进行反应:
中,1 mol X和1 mol Y进行反应:
2X(g) +Y(g)  Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
| A.以X浓度变化表示的反应速率为0.001 mol/(L·S) |
| B.将容器体积变为20 L,Z的平衡浓度为原来的1/2 |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的△H>0 |
下列叙述正确的是
| A.熔点由高到低的顺序是:金刚石>碳化硅>晶体硅 |
| B.分子晶体中,分子间的作用力越大,该分子越稳定 |
| C.油脂皂化后可用渗析的方法使高级脂肪酸钠与甘油充分分离 |
| D.布朗运动是胶体粒子特有的运动方式,可以据此把胶体和溶液、悬浊液区别开来 |
下列离子方程式表达正确的是
| A.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ |
| B.碳酸氢钙溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-===CaCO3↓+H2O |
| C.苯酚钠水溶液中通入足量CO2:C6H5O-+ CO2 + H2O = C6H5OH + CO32- |
| D.氯气溶于水:Cl2 + H2O= 2H+ + Cl- + ClO- |
如图是制备和收集气体的实验装置,该装置可用于()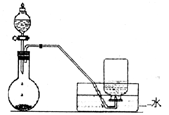
| A.浓硝酸与铜反应制取二氧化氮 |
| B.过氧化氢与二氧化锰反应制取氧气 |
| C.浓氨水和生石灰反应制取氨气 |
| D.浓盐酸和二氧化锰反应制取氯气 |
某同学按如图所示装置进行实验,A、B为常见金属,它们的硫酸盐可溶于水。当K闭合时,在交换膜处SO42-从右向左移动,系列分析正确的是()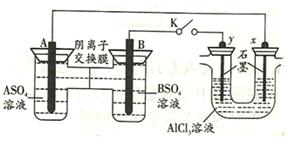
A.溶液中(A2+)浓度减小
B.B的电极反应为:B-2e-=B2-
C.y电极上有氢气产生,发生还原反应
D.反应初期x电极周围出现白色胶状沉淀,不久沉淀溶解
常温下,将amol/L的MOH(可溶性弱碱)与bmol/L的盐酸等体积混合,已知相同条件下MOH的电离程度大于M+的水解程度,则下列有关推论不正确的是()
| A.若混合后溶液的pH=7,则c(M+)=c(C1-) |
| B.若a=2b,则c (M+) > c(C1-) > c (MOH) > c(OH-) > c(H+) |
| C.若b=2a,则c(C1-) > c(M+) > c(H+) > c(OH-) |
| D.若混合后溶液满足c(H+)=c(OH-)+c(MOH),则可推出a=b |