实验室制取氯气方法很多,通常有如下三种:
(1)用二氧化锰与浓盐酸共热制取氯气。如果将过量二氧化锰与20 mL 12 mol/L的浓盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。产生该结果的主要原因是:① ,② 。
(2)高锰酸钾与浓盐酸反应可制取氯气,其反应的化学方程式为:
。
若消耗0.1 mol氧化剂,则被氧化的还原剂的物质的量为 mol。
(3)现按如下操作进行有关氯气的制备及性质实验:在一片下衬白纸的圆形玻璃片上(如下图),A点滴一滴0.1 mol/L KI溶液(含淀粉溶液),B点滴一滴FeSO4(含KSCN)溶液,C点滴一滴NaOH(含酚酞)溶液,O点放少量KClO3晶体。向KClO3晶体滴加一滴浓盐酸,立即用表面皿盖好。试回答下列问题: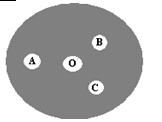
①A点反应的离子方程式为 ;
②B点的现象为 ;
③C点的溶液由红色变为无色,是因为中和褪色还是漂白而褪色,请你设计实验证明之。 。
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
 |
(1)判断BaCl2已过量的方法是。
(2)第④步中,相关的离子方程式是。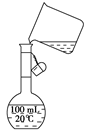 (3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是。
(4)为检验精盐纯度,需配制150 mL
0.2 mol/LNaCl(精盐)溶液,
右图是该同学转移溶液的示意图,
图中的错误是。
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
 |





主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到b g
④从分液漏斗滴入6 mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明 。
(2)装置中干燥管B的作用是 。
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填“偏高”、“偏低”或“不变”)。
(4)步骤⑤的目的是 。
(5)步骤⑦的目的是 。
(6)该试样中纯碱的质量分数的计算式为 。
(7)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。
 过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。 Ⅰ.测定过氧化的含量
Ⅰ.测定过氧化的含量



 请填写下列空白:
请填写下列空白:
(1) 移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250mL ___________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250mL ___________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2) 用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。

 (3)滴定时,将高锰酸钾标准溶液注入______________________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是___________________________________________
(3)滴定时,将高锰酸钾标准溶液注入______________________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是___________________________________________ ______________________________________________________________。
______________________________________________________________。 (4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为______________________________________。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为______________________________________。 (5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。

 Ⅱ.探究过氧化氢的性质
Ⅱ.探究过氧化氢的性质 该化学小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
该化学小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。) 请将他们的实验方法和实验现象填入下表:
请将他们的实验方法和实验现象填入下表:
| 实 验 内 容 |
实 验 方 法 |
实 验 现 象 |
| 验证氧化性 |
||
| 验证不稳定性 |
二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:



①将干燥的氯气在110 ℃~140 ℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表:
| 物质 |
熔点/℃ |
沸点/℃ |
化学性质 |
| S |
112.8 |
444.6 |
略 |
| S2Cl2 |
-77 |
137 |
 遇水生成HCl、SO2、S;300 ℃以上完全分解:S2Cl2+Cl2 2SCl2 遇水生成HCl、SO2、S;300 ℃以上完全分解:S2Cl2+Cl2 2SCl2 |
设计实验装置图如下:
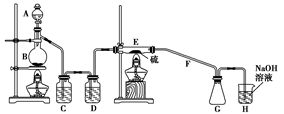 |
(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见 。
利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式: ;
E中反应的化学方程式: 。
(3)C、D中的试剂分别是 、 。
(4)仪器A、B的名称分别是 、 ,
F的作用是 。
(5)如果在加热E时温度过高,对实验结果的影响是 ,在F中可能出现的现象是 。
(6)S2Cl2粗品中可能混有的杂质是(填写两种) 、 ,为了提高S2Cl2的纯度,关键的操作是控制好温度和 。
浓H2SO4和木炭在加热时发生反应的化学方程式是2 H2SO4 (浓) +C CO2↑+ 2 H2O + 2SO2↑
请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)

将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
| 选用的仪器 (填字母) |
加入的试剂 |
作用 |