A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如下图所示: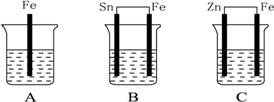
(1)A中反应的离子方程式是 。
(2)B中Sn极的电极反应式为____________________,Sn极附近溶液的pH__________(填“增大”“减小”或“不变”)。
(3)C中被腐蚀的金属是__________,总反应离子方程式是____________________,比较A、B、C中铁被腐蚀的速率由快到慢的顺序是__________。
发生化学反应时,破坏化学键需要能量,形成化学键需要能量。吸收能量用E1表示,释放能量用E2表示,当E1E2时,反应吸收能量;当E1E2时,反应释放能量
工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体: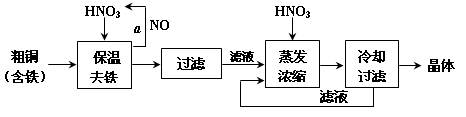
(1)在步骤a中,还需要通入氧气和水,发生反应的化学方程式是
。
(2)在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在范围。若调节溶液的pH=4,此时,溶液中c (Fe3+) =。[已知该条件下,Fe(OH)3的KSP= 4.0×10-36 ]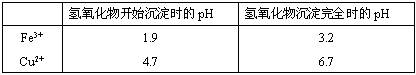
(3)不用加水的方法调节溶液pH的原因是。
(4)进行蒸发浓缩时,要加适量的硝酸以保持溶液一定的c(H+),其目的是(结合离子方程式简要说明)。
(5)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是。
[化学——有机化学基础]
Ⅰ.对羟基肉桂酸是一种强效的导电材料,在液晶显示器工业中近年来研究广泛。结构简式如图。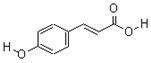
(1)该有机物具有的官能团名称是(写出其中的两种)。
(2)该有机物能发生的反应类型是(填写代号)。
A.氧化反应 B.消去反应 C.加聚反应 D.水解反应
Ⅱ.芳香族化合物C10H10O2有如下的转化关系: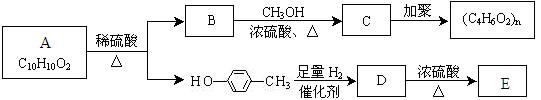
已知E能使Br2/CCl4溶液褪色。请回答下列问题:
(3)请分别写出A、E的结构简式A E。
(4)若有机物F与C互为同分异构体,则与有机物B为同系物的F的同分异构体有种
(5)请写出B→C反应的化学方程式。
[化学——物质结构与性质]
已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子。请回答下列问题:
(1)E元素基态原子的电子排布式为。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为(填元素符号)。
(3)D元素与氟元素相比,电负性:DF(填“>”、“=”或“<”)。
(4)BD2在高温高压下所形成的晶体其晶胞如图所示。该晶体的类型属于(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为。l mol B2A2分子中含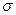 键的数目是。
键的数目是。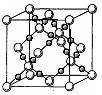
(5)光谱证实单质E与强碱溶液反应有[E(OH)4]—生成,则[E(OH)4]—中存在。
a.共价键 b.配位键 c.σ键 d.π键
物质A、B、C有如下转化关系: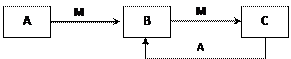
请回答下列问题:
(1)若A、B、C均为含铝元素的化合物,M可以是 。
(2)若M是第IVA族某元素的最高价氧化物,且M为气体,组成A的阴阳离子均含有10个电子,请写出C的名称 
(3)若A是一种黄绿色气体,M是一种常见金属。写出C→B的离子方程式
。
(4)若A、B、C都是含硫化合物,已知:
A转化为B的热化学方程式:2H2S(g)+ O2(g) =2S (s)+2H2O(l) △H= -a kJ·mol-1;
A转化为C的热化学方程式:2H2S(g)+ 3O2(g) =2SO2(g)+2H2O(l) △H= -b kJ·mol-1;
请写出A与C反应转化为B的热化学方程式。
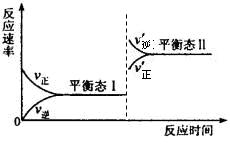
(5)若C+A→B的转化关系为4NH3+6NO 6H2O+5N2。在一定条件下,该反应达到平衡态I后,升高温度平衡发生移动,达到平衡态II的反应速率随时间变化的关系如图。该反应为 (填“吸热”或“放热”)反应;升高温度,该反应的平衡常数K值 (填“增大”、“减小”或“不变”)
6H2O+5N2。在一定条件下,该反应达到平衡态I后,升高温度平衡发生移动,达到平衡态II的反应速率随时间变化的关系如图。该反应为 (填“吸热”或“放热”)反应;升高温度,该反应的平衡常数K值 (填“增大”、“减小”或“不变”)