有机物A的结构简式是 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质:
B. C.
C.
D. E.
E.
(1)E中含氧官能团的名称为 。
(2)写出A制取C、D两种物质的有机类型:C 、D 。
(3)写出由A制取B的化学方程式:  。
。
A、B、C、D、E、F为前四周期原子序数依次增大的非稀有气体元素。其中:A的一种单质是自然界最硬的物质;B与A同周期且基态原子中s能级与p能级上的电子数相等;C于B同主族;D为同周期电负性最大的元素;E为使用最为广泛的金属;F的基态原子中没有单电子。请回答下列有关问题:
(1)写出E的基态原子的价层电子排布式;
(2)AB2的水化物中A的杂化方式为,CD2的空间构型为;
(3)K3[E(CN)6](此处C为碳元素符号)中配位数为,配体的电子式为;
(4)某矿石主要成分甲的晶胞如图,甲能与水反应,则甲的化学式为,属于晶体; 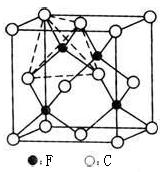
(5)CD2与CB3可以合成广泛用于有机合成的化合物CBD2,同时得到另一种与臭氧互为等电子体的化合物,写出该反应的化学方程式;
(6)纳米颗粒E3B4在磁性录像带、磁性存储器、磁性光盘、铁氧体磁芯、波导管和变压器等方面应用广泛,制取该颗粒时,将0.3mol/L ESO4的水溶液和0.4mol/L ECl3的水溶液以体积比2∶1进行混合。根据E3B4的组成分析按此用量混合可能的原因是。
(18分)研究SO2、NOx、CO等气体的性质对工业生产和环境保护具有重要意义。
(1)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为________________,所得溶液中 _________ (填字母编号)。
_________ (填字母编号)。
(2)通过NOx传感器可监测大气中NOx的含量,其工作原理如图所示,甲、乙两电极均Pt电极,电解质为熔融氧化物。
①乙电极上发生的是_________反应(填“氧化”或“还原”);
②甲电极上的电极反应式为___________________。
(3)将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g) CO2(g)+H2(g) △H,得到如下数据:
CO2(g)+H2(g) △H,得到如下数据:
①由表中数据可知该反应的△H________ 0(填“>”或“<”)。
②650℃时,若在此容器中开始充入2mol H2O(g)、lmol CO、1 mol CO2和2 molH2,则反应在开始时_________进行(填“正向”或“逆向”)。
③实验III中a=______,达平衡时实验II和实验III中H2O(g)的转化率的大小关系为: (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(16分)氢气是一种理想的“绿色能源”,利用氢能需要选择合适的储氢材料。目前正在研究和使用的储氢材料有镁系合金、稀土系合金等。
(2)储氢材料Mg(AlH4)2在110~200℃的反应为:Mg(AlH4)2==MgH2+2Al+3H2↑。
反应中每转移3mol电子时,产生的H2在标准状况下的体积为__________L。
(3)镧镍合金在一定条件下可吸收氢气形成氢化物:
 LaNi5H6(s)
LaNi5H6(s) ,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是_______(填字母编号)。
,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是_______(填字母编号)。
a.增加LaNi5H6(s)的量
b.升高温度
c.减小压强
d.使用催化剂
(4)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
①某温度下,向恒容密闭容器中加入环己烷,起始浓度为amol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=____________(用含a、b的代数式表示)。
②一定条件下,下图装置可实现有机物的电化学储氢(忽略其它有机物)。
A是电源的______极(填“正”或“负”);电解过程中产生的气体F为_____(填化学式):电极D上发生的电极反应为__________________。
【化学——选修3:物质结构与性质】
目前半导体生产展开了一场“铜芯片”革命——在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:
(1)基态铜原子的外围电子层排布为__________________,硫、氧元素相比,第一电离能较大的元素是________(填元素符号)。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是________,其立体结构是______________。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液 蓝色沉淀
蓝色沉淀 沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式_______________________;深蓝色透明溶液中的阳离子内存在的化学键类型有。
沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式_______________________;深蓝色透明溶液中的阳离子内存在的化学键类型有。
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途,铜晶体中铜原子堆积模型为_____________;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为________cm。((用含d和NA的式子表示)。
【化学——选修2:化学与技术】
某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO,从该矿石中提取钴的主要工艺流程如下:
(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如图所示。考虑生产成本和效率,最佳的浸出时间为小时,最佳的浸出温度为℃。
(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+H2O+Na2CO3=Na2Fe6(SO4)4(OH)12↓+Na2SO4+CO2↑
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF=MgF2↓+Na2SO4;
CaSO4+2NaF=CaF2↓+Na2SO4。已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的c(Ca2+)/c(Mg2+)=。
(4)“沉淀”中含杂质离子主要有;“操作X”名称为。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,电池反应为LiCoO2+ C6 CoO2+ LiC6。LiC6中Li的化合价为价。若放电时有1mole-转移,正极质量增加g。
CoO2+ LiC6。LiC6中Li的化合价为价。若放电时有1mole-转移,正极质量增加g。