制印刷电路板时常用氯化铁溶液作为“腐蚀液”,其反应的化学方程式为Cu+2FeCl3=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
| A.烧杯中有铜无铁 | B.烧杯中铁、铜都无 |
| C.烧杯中铜、铁都有 | D.烧杯中有铁无铜 |
下列做法中用到物质氧化性的是()
| A.明矾净化水 | B.纯碱除去油污 |
| C.臭氧消毒餐具 | D.食醋清洗水垢 |
拟用下图所示装置制取四种干燥、纯净的气体(图中加热装置和气体的收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中不能达到目的的是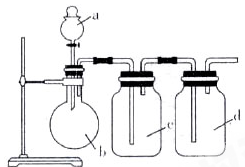
| 选项 |
制取气体 |
a |
b |
c |
d |
| A |
NO |
稀硝酸 |
铜片 |
H2O |
浓硫酸 |
| B |
O2 |
双氧水 |
MnO2 |
H2O |
浓硫酸 |
| C |
NH3 |
浓氨水 |
碱石灰 |
浓硫酸 |
H2O |
| D |
SO2 |
浓盐酸 |
Na2SO3粉末 |
NaHSO3溶液 |
浓硫酸 |
如下表所示,为提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法都正确的是
| 不纯物质 |
除杂试剂 |
分离方法 |
|
| A |
苯(甲苯) |
KMnO4(酸化),NaOH溶液 |
分液 |
| B |
NH4Cl溶液(FeCl3) |
NaOH溶液 |
过滤 |
| C |
乙酸乙酯(乙酸) |
KOH溶液,水 |
分液 |
| D |
CO2(SO2) |
Na2CO3 |
先气 |
下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 |
实验操作 |
实验目的或结论 |
| A |
某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 |
说明该钾盐是K2CO3 |
| B |
向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 |
除去MgCl2溶液中少量FeCl3 |
| C |
常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 |
说明常温下K sp(BaCO3)<K sp(BaSO3) |
| D |
C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 |
检验制得的气体是否为乙烯 |
关于某无色溶液中所含离子的鉴别,下列判断正确的是
| A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在 |
| B.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在 |
| C.加入Ba(NO3)2,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在 |
| D.加入盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-存在 |