在有乙离子存在的条件下,欲用试剂丙来检验溶液中是否含有甲离子,下表所加试剂丙不合理的是(在实验过程中不允许加热、过滤等操作)
| 选项 |
试剂丙 |
甲离子 |
乙离子 |
| A |
HNO3、BaCl2 |
SO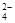 |
SO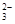 [ [ |
| B |
HNO3、AgNO3 |
Cl? |
CO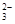 [ [ |
| C |
HCl |
SiO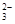 |
CO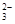 |
| D |
NH3、H2O |
Mg2+ |
Ag? |
已知32 g X与40 g Y恰好完全反应,生成m g Q和9 g H,在相同条件下,16 g X和足量Y混合生成0.25 mol Q和若干摩的H,则物质Q的摩尔质量应是( )
| A.122 g·mol-1 | B.63 g·mol-1 | C.126 g·mol-1 | D.163 g·mol-1 |
今有0.1 mol·L-1 Na2SO4溶液300 mL,0.1 mol·L-1 MgSO4溶液200 mL和0.1 mol·L-1 Al2(SO4)3溶液100 mL,这三种溶液中硫酸根离子浓度之比是( )
| A.1∶1∶1 | B.3∶2∶1 | C.3∶2∶3 | D.1∶1∶3 |
下列叙述正确的是( )
| A.同温同压下,相同体积的物质,它们的物质的量必相等 |
| B.任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等 |
| C.1 L一氧化碳气体一定比1 L氧气的质量小 |
| D.等体积、等物质的量浓度的强酸中所含的H+数一定相等 |
下列说法不正确的是( )
| A.磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等 |
| B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14∶1 |
| C.32 g氧气所含的原子数目为2×6.02×1023 |
| D.常温常压下,0.5×6.02×1023个一氧化碳分子所占体积是11.2 L |
在一定条件下,1体积气体A2和3体积气体B2完全反应生成了2体积气体(体积在相同条件下测定),则X的化学式是( )
| A.AB | B.A2B3 | C.AB2 | D.AB3 |