用惰性电极电解一定量的硫酸铜溶液,实验装置如图①。电解过程中的实验数据如图②, 横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积 (标准状况)。则下列说法正确的是( )
| A.电解过程中,b电极表面先有红色物质析出,后有气泡产牛 |
| B.a电极上发生的反应方程式为:2H++2e-一H2↑和4OH-—4e-==2H2O十O2↑ |
| C.曲线0~P段表示H2和O2混合气体的体积变化,曲线P~Q段表示O2的体积变化 |
| D.从开始到Q点时收集到的混合气体的平均摩尔质量为17g·mol-1 |
关于右图装置的叙述,正确的是()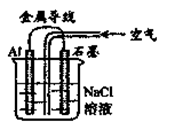
| A.铝是负极,铝片上析出无色气体 |
| B.石墨是阳极,石墨棒上析出黄绿色气体 |
| C.溶液中两电极间产生白色沉淀 |
| D.溶液中先产生白色沉淀,最后沉淀溶解 |
已知:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H=74.9kJ·mol-1,下列说法中正确的是()
△H=74.9kJ·mol-1,下列说法中正确的是()
| A.该反应中熵变、焓变皆大于0 |
| B.该反应是吸热反应,因此一定不能自发进行 |
| C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行 |
| D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
25℃、101kPa下:①2Na(s)+ O2(g)=Na2O(s) △H = -414kJ·mol-1
O2(g)=Na2O(s) △H = -414kJ·mol-1
②2Na(s)+O2(g)=Na2O2(s) △H = -511kJ·mol-1
下列说法正确的是()
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.25℃、101kPa下:Na2O2(s)+2Na(s)=2Na2O(s) △H = -317kJ·mol-1 |
高温下,某反应达到平衡,平衡常数K=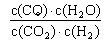 。恒容时,温度升高,H2浓度减小。下列说法正确的是()
。恒容时,温度升高,H2浓度减小。下列说法正确的是()
| A.该反应的焓变为正值 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应化学方程式为CO+H2O CO2+H2 CO2+H2 |
汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据此反应判断下列叙述中正确的是()
| A.PbO2是电池的负极 |
| B.负极的电极反应式为:Pb+SO42--2e–=PbSO4 |
| C.PbO2得电子,被氧化 |
| D.电池放电时,溶液酸性增强 |