现有X、Y、Z、W四种常见元素,其中X、Y、Z为短周期元素。有关信息如下表:
| |
原子或分子相关信息 |
单质及其化合物相关信息 |
| X |
ZX4分子空间结构为正四面体 |
X的最高价氧化物对应的水化物为无机酸中最强酸 |
| Y |
Y原子的最外层电子数等于电 |
Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料(人造刚玉) |
| Z |
Z原子的最外层电子数是次外层电子数的 |
Z是无机非金属材料的主角,其单质为原子晶体,是一种优良的半导体材料 |
| W |
W原子的最外层电予数小于4 |
W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
(1)W位于周期表第四周期第 族,W(OH)2在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为 。
(2)Z最简单的氧化物分子是 分了(填“极性”或“非极性”):工业上用Z的氧化物制备其单质的化学反应方程式为 。
锗与Z是同一主族元素,门捷列夫曾预言了这一元素的存在,它最常用来制造晶体篱,最新研究表明:有机锗具有明显的抗肿瘤活性,锗元素的最高价氧化物的化学式为 。
(3)实验室制取X单质的离子方程式为 ;X的气态氧化物的水溶液与Y的氧化物反应的离子方程式为 。
(4)在50mL lmol·L-1的YX3溶液中逐滴加入0.5mol·L-1的NaOH溶液,得到1.56g沉淀,则加入NaOH溶液的体积可能为 mL或 mL。
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温 度(℃) |
360 |
440 |
520 |
| K值 |
0.036 |
0.010 |
0.0038 |
(1)①写出工业合成氨的化学方程式。
②由上表数据可知该反应为放热反应,理由是。
③理论上,为了增大平衡时H2的转化率,可采取的措施是。(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g)+H2O (g) CO(g)+3H2(g) 获取,已知该反应中,当初始混合气
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气
中的  恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
①图中,两条曲线表示压强的关系是:P1P2(填“>”、“=”或“<”)。
②该反应为反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g)+H2O(g) CO2 (g)+H2(g) 获取。
CO2 (g)+H2(g) 获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度
为0.08 mol·L-1,则平衡时CO的转化率为,该温度下反应的平衡常数K值为。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说
明体系处于平衡状态的是(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2)=1 : 16 : 6 : 6
某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
I.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
II.向I所得固体中加入过量稀H2SO4,充分反应后过滤;
III.向II所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
IV.(1)步骤I中发生反应的化学方程式为、。
(2)步骤II所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其
可能的原因。
(3)步骤III获得CuSO4溶液的离子方程式为。
(4)步骤II所得滤液经进一步处理可制得Na2FeO4,流程如下:
①测得滤液中c(Fe2+) 为a mol·L-1,若要处理1 m3滤液,理论上需要消耗25 % 的H2O2溶液_________kg
(用含a的代数式表示)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式___________。
中学化学中常见的几种物质存在下图所示的转化关系。其中,A是一种黑色粉末状固体,C是一种黄绿色气体,实验室中常用E溶液吸收多余的C。(图中部分产物和反应条件已略去)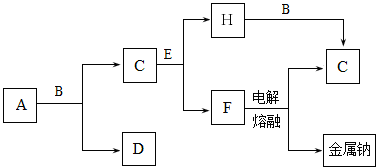
回答下列问题:
(1)写出A与B的浓溶液反应的化学方程式。
(2)固体E中含有化学键的类型是,C与E反应的离子方程式为。
(3)将B的浓溶液与H的浓溶液混合,立即产生大量气体C,该反应的离子方程式为。
(4)某课外小组的同学用E溶液吸收C,利用下图所示装置向吸收液中持续通入SO2气体。
实验过程中观察到如下现象:
①开始时,溶液上方出现白雾,试纸a变红。甲同学认为是HCl使a变红,乙同学不同意甲的观点,乙同学的认为使a变红的是(写出一种即可)。
②片刻后,溶液上方出现黄绿色气体,试纸b变蓝。用离子方程式解释b变蓝的原因。
③最终试纸b褪色。同学们认为可能的原因有两种:一是I2有还原性,黄绿色气体等物质将其氧化成
IO3-,从而使蓝色消失;二是。
X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2, Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请回答下列问题:
(1)元素X的最高价氧化物的电子式为;元素Z的离子结构示意图为。
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为。
(3)元素W位于周期表的第族, 其非金属性比元素R弱,用原子结构的知识解释原
因。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做其吸收剂,写出吸收剂
与足量该氧化物反应的离子方程式。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在
高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为。
沼气(主要成分是甲烷)是一种廉价的能源,把农村中大量存在的农作物秸秆、杂草、人畜粪便等在沼气池中发酵,便可产生沼气,沼气完全燃烧可以用来点灯、做饭。
(1)在101kPa时,32gCH4燃烧生成CO2和气态H2O,放出1604kJ的热量,写出甲烷燃烧的热化学方程式为__________________________________________________________。
(2)120℃,取CH4和过量O2的混合气体共0.4mol,点燃使其充分反应,将燃烧后的气体通过足量的碱石灰(NaOH和CaO的固体混合物)充分吸收,碱石灰增重8g。计算:原混合气体中CH4和O2的体积比是多少?