25℃时,在20mL0.1mol·L-1的氢氧化钠溶液中,逐滴加入0.2 mol·L-1 CH3COOH,溶液pH的变化曲线如图所示,有关粒子浓度关系的比较不正确的是 ( )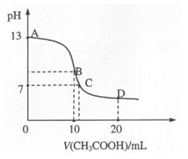
A.B点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.C点:c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
C.D点时,c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.对曲线上A、B间任何一点,溶液中都有:
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
在下图装置中,若通电一段时间后乙装置左侧电极质量增加,下列说法错误的是
| A.当甲装置中共产生标准状况下4.48 L气体时,Cu电极上质量增加43.2g |
| B.电解过程中装置丙的pH无变化 |
| C.丙中硝酸银溶液的浓度不变 |
| D.乙中左侧电极反应式:Cu2++2e-=Cu |
温度一定时, 于密闭容器中发生可逆反应: mA(气) + nB(气)  pC(气), 达到平衡后,若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1.9 倍,则下列叙述中正确的是
pC(气), 达到平衡后,若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1.9 倍,则下列叙述中正确的是
| A.平衡向逆反应方向移动 |
| B.C气体的体积分数增大 |
| C.气体A的转化率升高 |
| D.m + n > p |
在密闭容器中,反应2X(g)+ Y2(g)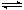 2XY(g);△H<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,下列分析正确的是
2XY(g);△H<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,下列分析正确的是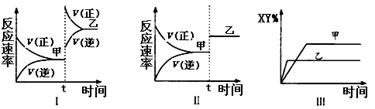
| A.图I中,甲、乙的平衡常数分别为K1、K2,则K1<K2 |
| B.图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低 |
| C.图Ⅱ中,t时间是增大了压强 |
| D.图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲 |
已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1
H-H、O=O和O-H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462kJ·mol-1,则a为
| A.-332 | B.-118 | C.+350 | D.+130 |
下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应: 
但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是
| A.纯Ni(s)和Ni(CO)4(g) |
| B.纯Ni(s)和CO(g) |
| C.不纯Ni(s)和CO(g) |
| D.不纯Ni(s)和Ni(CO)4(g) |