南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
(1)该泉水属于 硬水(填写“暂时”或“永久”)
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,加入顺序为 ,原因是 。
(3)目前常用阴、阳离子交换树脂来进行水的软化,如水中的Ca2+、Mg2+与交换树脂的起离子交换作用。当阴离子交换树脂失效后可放入 溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。 下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl- 、Ca2+、Mg2+、
下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl- 、Ca2+、Mg2+、 等离子,电极为惰性电极。请分析下列问题:
等离子,电极为惰性电极。请分析下列问题:
阳离子交换膜是指 (填A或B)。
A、B、C、D、E、F六种短周期元素的原子序数依次增大。A、D同族,B、C同周期;C是F不同周期的邻族元素;B原子最外层电子数是次外层的两倍;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和;E和F的原子序数之和为30。由上述六种元素中的两种元素组成的甲、乙、丙、丁、戊、己六种化合物如下图所示:
请完成下列问题:
(1)化合物己的电子式:________________。
(2)向含有1 mol乙的水溶液中加入MnO2,该反应中电子转移的物质的量为______mol。
(3)化合物丙中所有的原子都在同一直线上,实验室制取丙的化学方程式为____________。
(4)F的单质与甲反应的离子方程式为_______________。
(5)将丁与二氧化碳反应生成的盐置于戊的水溶液中,发生反应的离子方程式为___________。
下表是元素周期表的一部分,完成下列有关问题:

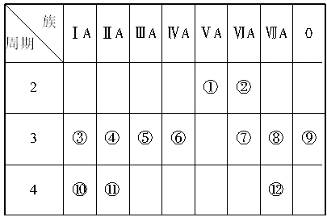
(1)写出下列元素符号:①__________,⑥__________,⑦__________,⑪__________。
(2)在这些元素中,最活泼的金属元素是_____,最活泼的非金属元素是_____,最不活泼的元素是_____。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是_____,碱性最强的是_____,呈两性的氢氧化物是_____,写出三者之间相互反应的化学方程式:_______________
(4)在这些元素中,原子半径最小的是_____,原子半径最大的是_____。
(5)在③与④中,化学性质较活泼的是,怎样用化学实验证明?答:__________。在⑧和⑫中,化学性质较活泼的是_____,怎样用化学实验证明?
有X、Y、Z、W、U五种1~20号元素,它们的原子序数依次增大,其中Z和U是金属元素,X和U同族,它们的最外电子层都只有一个电子。Y和W是周期表中相邻的两种元素,它们原子的最外层上的电子数都是X原子电子总数的6倍,Z原子最外层电子数等于W原子最外层电子数的一半。据此完成以下问题:
(1)X元素符号是_____,W离子的结构示意图是__________。
(2)写出Z元素最高价氧化物对应水化物与U和X2Y反应所得溶液作用的离子方程式_______________。
(3)由这五种元素组成的一种化合物的化学式是_______________。
有四种化合物W、X、Y、Z,它们都是由短周期元素A、B、C、D、E中的两种元素组成的。已知:
(a)A、B、C、D、E五种元素的原子序数依次增大,且A、D同主族,C、E同主族,B、C同周期。
(b)W由A、B组成,分子中原子个数比为A∶B=1∶1,常温时为气态。
(c)X由A、C组成,分子中原子个数比为A∶B=2∶1,常温时为液态。
(d)Y是由C、D形成的离子化合物,且Y中相应元素的微粒之比为:C∶D=1∶1。
(e)Z是由D、E形成的离子化合物,其中阳离子比阴离子少一个电子层,阴、阳离子个数比为1∶2。试完成下列各小题:
(1)各元素符号:A_____,B_____,C_____,D_____,E_____。
(2)W的化学式:__________。
(3)X的结构式:__________。
(4)Y的电子式:__________。
(5)Z的化学式:__________。
(6)写出下列反应化学方程式:Y与水反应__________。
A、B、C、D是四种短周期主族元素,其中B的原子序数最小,A、B同主族,C、D同主族,A比C的核外少两个电子;D元素一种原子的质量数是其质子数的两倍多2,又是该原子最外层电子数的3倍。判断A、B、C、D各是什么元素,并比较A、B、C三种元素的最高价氧化物对应的水化物溶液酸、碱性的相对强弱。
(1)A_____、B_____、C_____、D_____。(填元素符号)
(2) _____ (填酸性或碱性):_____>_____>_____。(填分子式)