(16分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。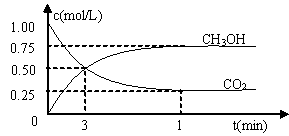
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。氢气的转化率为 。
②下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升 高温度 B.充入He(g),使体系压强增大
高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
⑵工业上也可以用CO和H2合成甲醇,反应原理为:CO(g)+2H2(g) CH3OH(g) △H=-128.8kJ/mol,在温度不变的情况下,若在增大容器体积的
CH3OH(g) △H=-128.8kJ/mol,在温度不变的情况下,若在增大容器体积的 同时不断充入氢气,使H2的浓度保持不变,则平衡 ;
同时不断充入氢气,使H2的浓度保持不变,则平衡 ;
A.向正反应方向移动 B.向逆反应方向移动
C.不移动 D.无法判断
作出此判断的理由是 。
硅在地壳中的含量较高,硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)陶瓷、水泥和玻璃是常用的传统的无机非金属材料,其中生产普通玻璃的主要原料有。
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
①工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃除生成粗硅外,也可以生产碳化硅,则在电弧炉内可能发生的反应的化学方程式为。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,粗硅生成SiHCl3的化学反应方程式。
(3)有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和;SiHCl3极易水解,其完全水解的产物为。
| 物质 |
Si |
SiCl4 |
SiHCl3 |
SiH2Cl2 |
SiH3Cl |
HCl |
SiH4 |
| 沸点/℃ |
2355 |
57.6 |
31.8 |
8.2 |
-30.4 |
-84.9 |
-111.9 |
(4)还原炉中发生的化学反应为:。
(5)氯碱工业可为上述工艺生产提供部分原料,这些原料是。
为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
(1)第①步Cu与混酸反应的离子方程式为______________________________。得到滤渣1的主要成分为_________________。
(2)第②步中加入H2O2的作用是__________________,使用H2O2的优点是_________;调溶液pH的目的是____________________________________。
(3)简述第③步由滤液2得到CuSO4·5H2O的方法是_________________________
____________________________________________________________ 。
(4)由滤渣2制取Al2(SO4)3·18H2O ,设计了以下三种方案:
上述三种方案中,_______方案不可行,原因是_______________________________;
从原子利用率角度考虑,_______方案更合理。
(5)用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2+ + H2Y2-→ CuY2- + 2H+。写出计算CuSO4·5H2O质量分数的表达式ω= __________________ 。
随着大气污染的日趋严重,国家拟于“十二”五期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) ="4NO(g)" + CO2(g) +2H2O(g)⊿H=" -574" kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g)⊿H=" -1160" kJ·mol-1
③H2O(g) = H2O(l)△H=" -44.0" kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式 。
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。
浓度/mol·L-1
时间/min |
NO |
N2 |
CO2 |
||
| 0 |
1.00 |
0 |
0 |
||
| 10 |
0.58 |
0.21 |
0.21 |
||
| 20 |
0.40 |
0.30 |
0.30 |
||
| 30 |
0.40 |
0.30 |
0.30 |
||
| 40 |
0.32 |
0.34 |
0.17 |
||
| 50 |
0.32 |
0.34 |
0.17 |
(3)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①10min~20min以v(CO2) 表示的平均反应速率为 。
②根据表中数据,计算T1℃时该反应的平衡常数为 (保留两位小数)。
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”) 。
④下列各项能作为判断该反应达到平衡的是 (填序号字母)。
A.容器内压强保持不变
B.2v正(NO) = v逆(N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是 。请在图中画出30min至40min的变化曲线。
以下几种物质是食用香精的主要成分
(1)以上三种食用香精都含有的官能团为_____________(填名称)。
(2)用于鉴别桂醛和玫瑰醇的试剂为____________________。
(3)写出符合下列条件的桂醛的同分异构体的结构简式________。
a.苯环上连接着两个互为对位的基团
b.有一个甲基
c.能与溴的四氯化碳溶液发生加成反应
d.遇FeCl3,溶液显示特征颜色
(4)已知醛在一定条件下可以两分子加成:
有机物M为芳香族化合物且与D一香芹酮互为同分异构体,其合成路线如下
①试剂X为______________;
②M的结构简式为____________;
③D发生加聚反应的化学方程式为____________________
芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。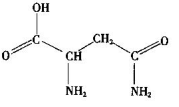
(1)天冬酰胺所含元素中,_______(填元素名称)元素基态原子核外未成对电子数最多。
(2)天冬酰胺中碳原子的杂化轨道类型有_______种。
(3)H2S和H2Se的参数对比见下表。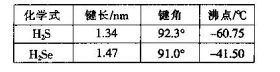
①H2Se的晶体类型为_________,含有的共价键类型为_________。
②H2S的键角大于H2Se的原因可能为____________________。
(4)已知铝(Mo)位于第五周期VIB族,钼、铬、锰的部分电离能如下表所示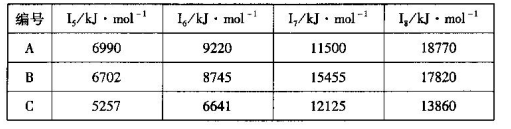
A是____________(填元素符号),B的价电子排布式为。