下列关于硅的说法不正确的是:
| A.硅是非金属元素,它的单质是灰黑色有金属光泽的固体 |
| B.硅的导电性能介于金属与绝缘体之间,是良好的半导体材料 |
| C.硅的化学性质不活泼,常温下不与任何物质反应 |
| D.加热到一定温度时,硅能与氢气.氧气等非金属发生反应 |
可逆反应H2(g) + I2(g)  2HI(g)达到平衡的标志是( )
2HI(g)达到平衡的标志是( )
| A.H2、I2、HI的浓度相等 | B.H2、I2、HI的浓度保持不变 |
| C.混合气体的密度保持不变 | D.混合气体的质量不再改变 |
使反应4NH3(g)+3O2(g)===2N2(g)+6H2O(g)在2 L的密闭容器中进行,半分钟后N2的物质的量增加了0.6 mol。此反应的平均反应速率可表示为( )
| A.v(NH3)=0.02 mol·L-1·s-1 | B.v(O2)=0.01 mol·L-1·s-1 |
| C.v(N2)=0.02 mol·L-1·s-1 | D.v(H2O)=0.02 mol·L-1·s-1 |
下列说法中有明显错误的是( )
| A.对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大 |
| B.活化分子之间发生的碰撞不一定为有效碰撞 |
| C.升高温度,一般可使活化分子的百分数增大,因而反应速率增大 |
| D.加入适宜的催化剂,使分子能量增加从而可使活化分子的百分数大大增加,从而成千上万倍地增大反应速率 |
在可逆反应:2A + 3B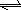 2C,改变下列条件一定能加快反应速率的是( )
2C,改变下列条件一定能加快反应速率的是( )
| A.增大反应物的量 | B.升高温度 |
| C.增大压强 | D.减小生成物的量 |
S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g) ="=" SO2(g)△H1=-297.16 kJ·mol-1
②S(正交,s)+O2(g) ="=" SO2(g)△H2=-296.83 kJ·mol-1
③S(单斜,s) ="=" S(正交,s)△H3
下列说法正确的是( )
| A.△H3=0.33 kJ·mol-1 |
| B.单斜硫转化为正交硫的反应是吸热反应 |
| C.S(单斜,s) ="=" S(正交,s) △H3<0,正交硫比单斜硫稳定 |
| D.S(单斜,s) ="=" S(正交,s)△H3>0,单斜硫比正交硫稳定 |