X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z |
Z和Y同周期,Z的电负性大于Y |
| W |
W的一种核素的质量数为63,中子数为34 |
(1)Y位于元素周期表第 周期表,第 族, 区,
(2)Y和Z的最高价氧化物对应的水化物的酸性较强的是 (写化学式)。
(3)W的基态原子核外电子排布式是 。
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y。
已知:
XO(g)+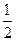 O2(g)=XO2(g)
O2(g)=XO2(g)  H=-283.0 kJ·mol-1
H=-283.0 kJ·mol-1
Y(g)+ O2(g)=YO2(g)  H=-296.0 kJ·mol-1
H=-296.0 kJ·mol-1
此反应的热化学方程式是 。
有A、B、C、D四种盐,组成它们的阳离子有:Ba2+、Ag+、N a+、Cu2+中,阴离子有:NO3-、Cl-、SO42-、CO32-。某同学设计实验对它们进行鉴别:
a+、Cu2+中,阴离子有:NO3-、Cl-、SO42-、CO32-。某同学设计实验对它们进行鉴别:
⑴把四种盐分别溶解于盛有蒸馏水的四支试管中,均得到澄清溶液。通过观察及分析,该同学得出如下结论:呈蓝色的溶液可以确定是A,则A为:(填化学式);
⑵再向未确定的三支试管中分别加入盐酸,则B盐溶液有沉淀产生,C盐溶液有无色无味气体产生。该同学确定另三种盐的化学式分别为:
B,C,D。(填化学式)
⑶请你帮该同学完成下列反应的离子方程式:
B+盐酸:
C+盐酸:
A与D混合:
已知电子工业上常用FeCl3溶液来溶解电路板。某一反应体系有反应物和生成物共三种物质:FeCl3、FeCl2、Fe 。完成下列问题:
(1)该反应中的氧化剂的化学式是。
(2)该反应中,发生还原反应的过程是(填化学式)→。
(3)写出离子方程式并标出电子转移的方向和数目
 。
。
(4)如反应转移了0.3mol电子,则溶解的铁的质量为克。
已知A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。①元素Y在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质。②常温下将气体D通入水中发生反应,生成C和E;③工业上以A、空气和水为原料,通过催化氧化法制取E。请回答以下问题:
⑴ B分子中含有的化学键为;A的分子式为;
(2)由B反应生成1molA放出的热量为46.2kJ,写出该反应的热化学方程式
将某一元酸HA与NaOH等体积混合,请根据题目
要求回答下列问题:
(1)若c(HA)=c(NaOH)=O.lmol/L,测得混合后溶液的pH>7。
①HA是弱电解质,能证明HA是弱电解质的方法是
A测得0.Imol/L HA的pH>l
B.测得NaA溶液的pH>7
C.pH=l的HA与盐酸,稀释10倍后,盐酸的pH变化大
D.用足量的锌分别与相同pH、相同体积的盐酸和HA反应,产生氢气一样多
②混合溶液中,关系式一定正确的是
A.c(A-)>c(Na+)c(OH-)>c(H+)
B.c(A-)+c(OH-)=c(Na+)+c(H+)
C.c(HA)+c(A-)=0.1mol/L
D.C( HA) +c( H+)= c(OH-)
③若HA(足量)+B2一A一+HB-;H2B(少量)+2C-B2-+2HC
HA+C-A-十HC
则相同pH的①NaA②Na2B③NaHB④NaC的四种溶液,各物质的物质的量浓度从大到小的顺序为(填序号)。
(2)若c( HA)==c(NaOH)==0.1mol/L,测得混合后溶液的pH=7。
①现将一定浓度的HA稀释10倍后溶液的pH与该浓度的HA和0.1 mol/L NaOH等体积混合后溶液的pH相等,则HA溶液的浓度为。
②用标准的NaOH溶液滴定未知浓度的HA时,下列操作能引起所测HA浓度偏低的是。
A.用蒸馏水洗涤锥形瓶后,用待测HA溶液进行润洗
B.滴定前发现滴定管的尖嘴部分有气泡,滴定后消失
C.装NaOH的碱式滴定管未用标准的NaOH溶液润洗
D.滴定前仰视,滴定后俯视读数
对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法: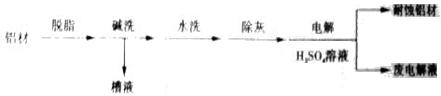
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是______(用离子方程式表示)。为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的_______________。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应为_______________。取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的原因(用离子方程式表示)___________________________。
(2)利用如图装置,可以模拟铁的电化学防护。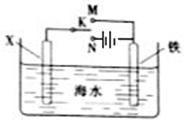
若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。若X为锌,开关K置于M处,该电化学防护法称为_______。