分析、归纳、探究是学习化学的重要方法和手段之一.下面就电解质A回答有关问题(假定以下都是室温时的溶液)。
(1)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=a
①当a=10时,A溶液呈碱性的原因是(用离子方式程式表示) 。
②当a=10,n=1时,A溶液中各种离子浓度由大到小的顺序为 ,
c(OH-)-c(HB)=________ mol/L。
③当n=1、c=0.1、溶液中c(HB)∶c(B-)=1∶99时,A溶液的pH为______(保留整数值)。
(2)已知难溶电解质A的化学式为XnYm,相对分子质量为M,测得其饱和溶液的密度为ρ g/cm3,Xm+离子的浓度为c mol/L,则该难溶物XnYm的溶度积常数为Ksp=_____________,该温度下XnYm的溶解度S=____________g
(10分)已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):
Cu+2H2SO4(浓)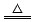 CuSO4+A↑+2H2O
CuSO4+A↑+2H2O
试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于______________(用字母代号填写)
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
A物质可以使酸性KMnO4溶液褪色,此反应中__________(填写化学式,下同) 失去电子,氧化剂
是____________。
(2)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的A气体在标准状况下体积为_________L (假设气体全部逸出)。
(3)将反应后所得到的溶液与足量Ba(OH)2溶液充分反应。请写出此过程发生的反应的离子方程式:______________________________________________________
计算反应后所得沉淀的质量为__________________g(保留到0.1g)。
(8分)(1)已知离子反应: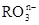 +6I—+6H+=R—+3I2+3H2O,n=_____,R元素在
+6I—+6H+=R—+3I2+3H2O,n=_____,R元素在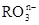 中的化合价是_____。
中的化合价是_____。
(2)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
①在上述有编号的步骤中,需用还原剂的是_______,需用氧化剂的是。 (填编号)。
②标出下面化学方程式电子转移的方向和数目(用双线桥表示),并回答有关问题
Na2Cr2O7+6KI+14HCl = 2CrCl3+2NaCl+6KCl+3I2+7H2O
反应中的还原剂___________。
(6分)a、b、c、d是HCl、BaCl2、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如下表所示:
| 反应物 |
a+b |
c+d |
a+d |
a+c |
b+d |
| 现象 |
白色沉淀 |
白色沉淀 |
白色沉淀 |
白色沉淀 |
无色气体 |
(1)请用化学式填写a是、b是、c是、d是
(2)写出a+c反应的离子方程式。
(6分)下表是某地市场销售的一种“加碘食盐”包装袋上的部分文字说明。
| 配 料 |
氯化钠、碘酸钾 |
| 含碘量 |
(20mg~40mg)/1kg |
| 保质期 |
18个月 |
| 食用方法 |
勿长时间炖炒 |
| 贮藏指南 |
避热、防潮 |
(1) 由食用方法和贮藏指南可推测碘酸钾的化学性质之一是_______________。
(2) 已知碘在碘酸钾中的化合价为+5,碘酸钾的化学式为_________________。
(3)用单质碘(I2)与氯酸钾发生置换反应可制得碘酸钾,该反应的化学方程式为
_____________________________________________________________。
(5分)图中方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示四种基本反应类型。请分别填出: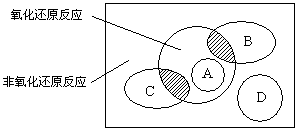
(1)若图中B圈表示化合反应,则C圈表示________反应(填基本反应类型,下同),A圈表示________反应,D圈表示________反应。
(2)B圈、C圈分别与氧化还原反应重叠的阴影部分用化学方程式各举出一例:
__________________________________;_________________________________。