常温下,在100ml 12mol·L—1的浓HNO3中加入足量的铁粉,最终产生标准状况下气体的体积为(不考虑NO2转化为N2O4)
| A.几乎无气体产生 | B.等于6.72L[来 |
| C.等于13.44L | D.介于6.72L至13.44L之间 |
【2015江苏化学】下列说法正确的是
| A.若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023 |
| B.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7 |
| C.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀 |
D.一定条件下反应N2+3H2 2NH3达到平衡时,3v正(H2)=2v逆(NH3) 2NH3达到平衡时,3v正(H2)=2v逆(NH3) |
【2015江苏化学】下列说法正确的是
| A.分子式为C2H6O的有机化合物性质相同 |
| B.相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能 途径a:C  CO+H2 CO+H2 CO2+H2O CO2+H2O途径b:C  CO2 CO2 |
| C.在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数 |
| D.通过化学变化可以直接将水转变为汽油 |
【2015海南化学】己知在碱性溶液中可发生如下反应:
2R(OH)3+ 3C1O-+ 4OH-= 2RO4n-+3Cl-+5H2O。则RO4n-中R的化合价是
| A.+3 | B.+4 | C.+5 | D.+6 |
【2015北京理综化学】在通风橱中进行下列实验:
| 步骤 |
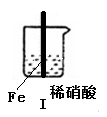 |
 |
|
| 现象 |
Fe表面产生大量无色气泡,液面上方变为红棕色 |
Fe表面产生少量红棕色气泡后,迅速停止 |
Fe、Cu接触后,其表面产生红棕色气泡 |
下列说法中不正确的是
A.Ⅰ种气体有无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
【2015上海化学】离子方程式2Ca2+ + 3HCO3– + 3OH– → 2CaCO3↓ + CO32– + 3H2O可以表示
| A.Ca(HCO3)2与NaOH溶液反应 | B.NaHCO3与澄清石灰水反应 |
| C.Ca(HCO3)2与澄清石灰水反应 | D.NH4HCO3与澄清石灰水反应 |