某学校附近的化工厂排出的污水中因含某些金属离子对水质和环境造成了污染。该校环境保护研究小组的同学对该厂排出的污水取样过滤,对滤液进行了多次检测,其中有三次检测的结果如下表所示。试回答: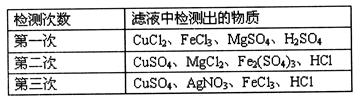
(1)三次检测的结果中第________次检测的结果不正确。
(2)研究小组根据检测结果,向化工厂提出建议:用一种含钠离子的化合物来处理污水,就可以同时除去检测出的金属离子。这种化合物_____________。
(3)在检测时,为了确定滤液中是否存在硫酸根离子和氯离子,同学们将滤液酸化后,首先向滤液中加入过量的_________溶液,将反应后的化合物过滤,再向得到的滤液中加入___________溶液。
[化学——有机化学基础](15分)丁苯酞(J)是治疗轻、中度急性脑缺血的药物,合成J的一种路线如下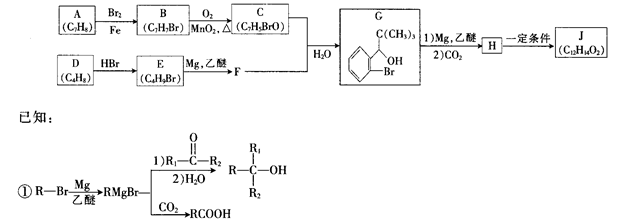
②E的核磁共振氢谱只有一组峰;
③C能发生银镜反应;
④J是一种酯,分子中除苯环外还含有一个五元环。
回答下列问题:
(1)由A生成B的化学方程式为 ,其反应类型为
(2)D的化学名称是
(3)J的结构简式为 ,由D生成E的化学方程式为
(4)G的同分异构体中核磁共振氢谱有4组峰且能与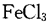 溶液发生显色反应的结构简式为 (写出一种即可)
溶液发生显色反应的结构简式为 (写出一种即可)
(5)由甲醛和化合物A经下列步骤可得到2一苯基乙醇。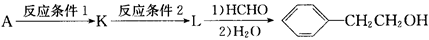
反应条件1为 ;反应条件2所选择的试剂为 ;L的结构简式为
[化学——物质结构与性质](15分)
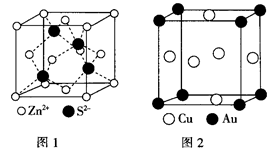
1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8等。回答下列问题:
(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于(填“晶 体”或“非晶体”)。
(2)基态铜原子有个未成对电子,二价铜离子的电子排布式为,在CuS04溶液中滴入过量氨水,形成配合物的颜色为。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2分子中含有共价键的数目为;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N="C=S" )的沸点,其原因是 。
(4)ZnS的晶胞结构如图1所示,在ZnS晶胞中,S2-的配位数为 。
(5)铜与金形成的金属互化物结构如图2,其晶胞边长为a nm,该金属互化物的密度为(用含“a、NA 的代数式表示)g·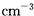 。
。
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有: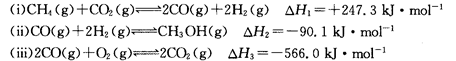
(1)用CH4和02直接制备甲醇蒸气的热化学方程式为。
(2)某温度下,向4 L恒容密闭容器中通人6 mol C02和6mol CH4,发生反应(i),平衡体系中各组分的体积分数均为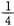 ,则此温度下该反应的平衡常数K=,CH4的转化率为。
,则此温度下该反应的平衡常数K=,CH4的转化率为。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为: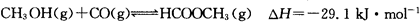 ,科研人员对该反应进行了研究,部分研究结果如下:
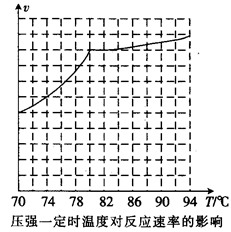
,科研人员对该反应进行了研究,部分研究结果如下: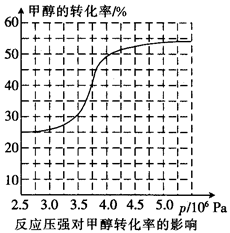
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是(填“3.5× 106 Pa”“4.O×106 Pa”或“5.0× 106 Pa”)。
②实际工业生产中采用的温度是80℃,其理由是。
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:
①通入a气体的电极是电池的(填“正”或“负”)极,其电极反应式为 .
②常温下,用此电池以惰性电极电解O.5 L饱和食盐水(足量),若两极共生成气体1.12 L(已折算为标准状况下的体积),则电解后溶液的pH为(忽略溶液的体积变化)。
立方烷( )具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物I的一种合成路线:
)具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物I的一种合成路线: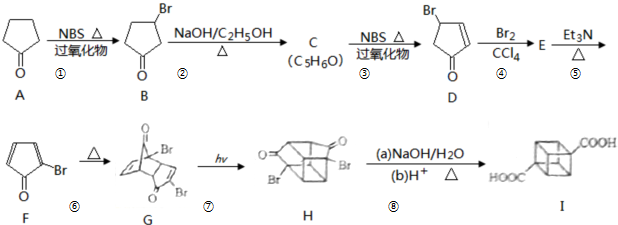
回答下列问题:
(1)C的结构简式为,E的结构简式为。
(2)③的反应类型为,⑤的反应类型为。
(3)化合物A可由环戊烷经三步反应合成:
反应1的试剂与条件为:反应2的化学方程式为:反应3可用的试剂为。
(4)在I的合成路线中,互为同分异构体的化合物是(填化合物代号)。
(5)I与碱石灰共热可转化为立方烷,立方烷的核磁共振氢谱中有个峰。
(6)立方烷经硝化可得到六硝基立方烷,其可能的结构有种。
A、B、C、D、E五种化合物,均含有前18号元素中某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。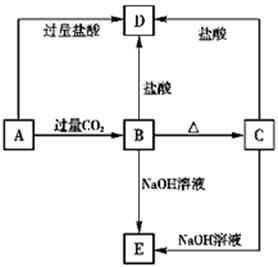
(1)写出化学式:A________,B________,C________,D________.
(2)写出下列反应的离子方程式:
B→D___________________,C→E_______________________