(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有: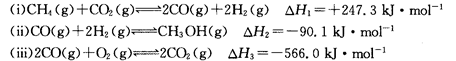
(1)用CH4和02直接制备甲醇蒸气的热化学方程式为 。
(2)某温度下,向4 L恒容密闭容器中通人6 mol C02和6mol CH4,发生反应(i),平衡体系中各组分的体积分数均为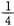 ,则此温度下该反应的平衡常数K= ,CH4的转化率为 。
,则此温度下该反应的平衡常数K= ,CH4的转化率为 。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为: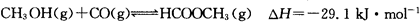 ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下: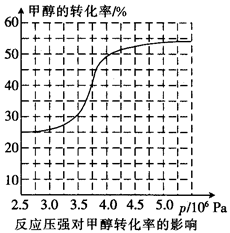
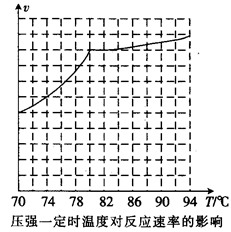
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 (填“3.5× 106 Pa”“4.O×106 Pa”或“5.0× 106 Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:
①通入a气体的电极是电池的 (填“正”或“负”)极,其电极反应式为 .
②常温下,用此电池以惰性电极电解O.5 L饱和食盐水(足量),若两极共生成气体1.12 L(已折算为标准状况下的体积),则电解后溶液的pH为 (忽略溶液的体积变化)。
对-甲基苯甲酸乙酯(F)是有机化工原料,用于合成药物的中间体,某兴趣小组利用中学的简单有机物进行合成,其方案如下: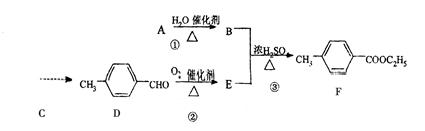
(1)A的结构简式是,E中含有的官能团名称是。
(2)指出化学反应类型:①;②。
(3)丁子香酚(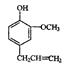 )是一种重要的调味剂,它与F的关系是。
)是一种重要的调味剂,它与F的关系是。
a.同系物 b.同分异构体 c.同种物质
(4)下列物质不能与丁子香酚发生反应的是。
a.NaOH溶液 b.NaHCO3溶液 c.Br2的四氯化碳溶液 d.乙醇
(5)写出反应③的化学方程式:。
(1)CCS技术是将工业和有关能源产业中所生产的CO2进行捕捉与封存的技术,被认为是拯救地球、应对全球气候变化最重要的手段之一。其中一种以天燃气为燃料的“燃烧前捕获系统”的简单流程图如图所示(部分条件及物 质未标出)。回答下列问题:
质未标出)。回答下列问题:
CH4在催化剂作用下实现第一步,也叫CH4不完全燃烧,1gCH4不完全燃烧反应放出2.21kJ热量,写出该反应的热化学方程式。
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用(1)转化中得到的合成气制备甲醇。反应为CO(g)+2H2(g) CH3OH(g)某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见下图:
CH3OH(g)某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见下图: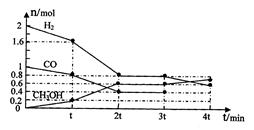
①根据上图计算,从反应开始到tmin时,用H2浓度变化表示的平均反应速率v(H2)=
②t min至2tmin时速率变化的原因可能是;
③3tmin时对反应体系采取了一个措施,至4tmin时CO的物质的量为0.5mol,请完成上图CO的曲线。
(3)某同学按下图所示的装置用甲醇燃料电池(装置Ⅰ)进行电解的相关操作,以测定铜的相对原子质量,其中c电极为铜棒,d电极为石墨,X溶液为500mL0.4mol/L硫酸铜溶液。当装置Ⅱ中某电极上收集到标准状况下的气体V1mL时,另一电极增重mg(m<12.8)。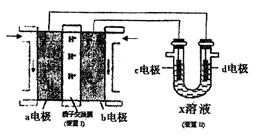
①装置Ⅰ中、H+向 极(填“a”或“b”)移动;b电极上发生的反应为。
极(填“a”或“b”)移动;b电极上发生的反应为。
②铜的相对原子质量的表 达式为(用m和V1的代数式表示)。
达式为(用m和V1的代数式表示)。
已知丙二酸二乙酯能发生以下反应:
有机物A在一定条件下可以发生如下图所示的转化(其他产物和水已省略)。其中相关物质的结构和性质为:A不含甲基,能与金属钠反应生成氢气;B所含碳原子数与A相同,且只含有一种官能团;C能发生银镜反应;1molD与足量碳酸氢钠溶液反应可产生二氧化碳2mol。
请结合图中其它信息回答下列问题:
(1)写出下列物质所具有的官能团的名称:C___________,D___________
(2)①~⑤反应中,属于取代反应的是________________(填序号)。
(3)写出A、G的结构简式:A___________, G_______ __________
(4)写出②、④反应的化学方程式:
②________________________________________________________________。
④_________________________________________________________________。
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
(1)已知:N2(g)+ O2(g)="2NO(g)" △H=+180.5 kJ/mol
2C(s)+ O2(g)="2CO(g)" △H="-221.0" kJ/mol
C(s)+ O2(g)=CO2(g) △H="-393.5" kJ/mol
尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=。
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表: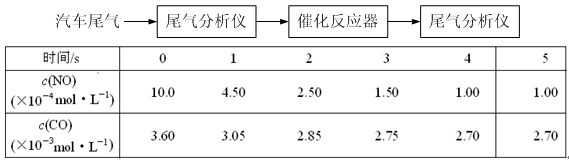
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率v (N2) = ___________________。
②在该温度下,反应的平衡常数K =。(只写出计算结果)
③对于该可逆反应,通过综合分析以上信息,至少可以说明(填字母)。
A.该反应的反应物混合后很不稳定
B.该反应一旦发生将在很短的时间内完成
C.该反应体系达到平衡时至少有一种反应物的百分含量较小
D.该反应在一定条件下能自发进行
E.该反应使用催化剂意义不大
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是。
A.负极的电极反应式为:CO+O2—―2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
A、B、R、D、E、F是六种原子序数依次增大的短周期元素, 其中有两种非金属元素位于同一主族。已知A、B、D均能与R形成原子(或离子)个数不同的几种常见化合物。请回答下列有关问题。
(1)仅由上述信息就可以确定的元素(写出代号与元素符号)是________________,若X、Y是D、F形成的最高价氧化物对应的水化物,浓度均为0.1mol/L的X、Y溶液的pH之和为14,则X、Y的晶体熔点相对高低为(写化学式)____________
(2) A与B、E均可形成正四面体构型的气态分子Q、P,又知P的燃烧热为1430kJ/mol,则其燃烧的热化学方程式____________________
(3) 上述六种元素间能形成多种常见二元化合物,其中存在两类化学键的物质的电子式为_______(写一种即可)
(4) R能形成多种单质,如R2、R3,研究表明,新近制得的一种组成为R4的分子中,每个R原子均与另外两个R原子各形成一个键,下列有关R4的说法中正确的是_______
①R4与R3、R2互为同位素②R4不能与A、B、D的单质反应
③R4中各原子最外电子层均为8电子结构④R4是一种新型化合物