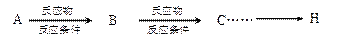某化学兴趣小组用以下装置探究SO2的某些化学性质。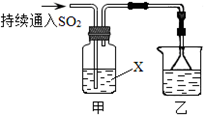
(1)装置乙的作用是 。
(2)若X为品红溶液,观察到溶液褪色,说明SO2具有 (填序号,下同);若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有 。
a.氧化性 b.还原性 c.漂白性
(3)若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式: Ca2++
Ca2++ ClO-+
ClO-+ SO2+
SO2+ H2O=
H2O= ↓+
↓+ Cl-+
Cl-+ SO42-+
SO42-+ 。
。
快乐是什么?精神病学专家通过实验发现:在大脑的相应部位——“奖赏中心”,给予柔和的电击,便会处于似乎极度快乐的状态.人们已经将“奖赏中心”各部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统.
多巴胺结构如图:
(1)多巴胺分子式:.
(2)试判断多巴胺能发生的化学反应.
| A.加成 | B.取代 | C.氧化 | D.水解 |
(3)写出与多巴胺互为同分异构体且满足下列三个条件的所有物质的结构简式:
①属于1、3、5三取代苯②苯环上直接连有一个羟基和一个氨基
③分别能与钠和氢氧化钠反应,消耗钠与氢氧化钠的物质的量之比为2:1
.
(4)多巴胺可由香兰素与硝基甲烷缩合,再经锌汞齐还原水解而得.合成过程表示如下: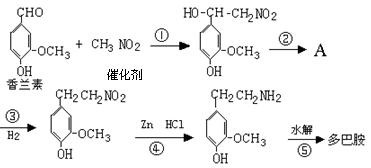
(Ⅰ) 写出下列反应类型:反应①,反应⑤.
(Ⅱ) A的结构简式:.
(Ⅲ) 写出②的化学方程式:.
(14分)
A~H是纯净物或溶液中的溶质,其中A是日常生活中常用的金属单质.它们之间有如下关系:(部分产物和反应条件略)
根据上述信息,回答下列问题:
(1)写出下列物质的化学式B,E.
(2)H和 SO2生成强酸F,此反应中氧化剂是.
(3)写出①的离子方程式:.
(4)写出②的化学方程式:.
(5)C溶液中滴入NaOH溶液有何现象?.
现有A、B、C、D四种常见的短周期主族元素,其原子序数依次增大.其中A、B是同周期相邻元素,且A单质及其氢化物是重要的工业生产原料;C、D是同周期元素,且在该周期中,分别为原子半径最大和最小的元素,C、D最外层电子数之和与B的原子序数相等,回答下列问题:
(1)B元素的名称为,C元素在周期表中位于第周期第族.
(2)工业上由A单质合成其氢化物的化学反应方程式为:.
(3)当今工业电解CD饱和水溶液的装置名称是,阳极电极反应式为,溶液的pH将(填“增大”、“减小”或“不变”),若有1mol电子转移,生成气体体积之和是L(标准状况下).
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF3是一种三角锥型分子,键角102°,沸点-129°C;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备NF3的化学反应方程式:。
(2)NF3的沸点比NH3的沸点(-33°C)低得多的主要原因是。
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为
。
(4)理论上HF、NaAlO2和NaCl按6∶1∶2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是,配位数为。
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
①在周期表中,最可能处于同一族的是和。
②T元素最可能是(填“s”、“p”、“d”、“ds”等)区元素,位于族。
若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物的空间构型为,其中心原子的杂化方式为。
2,3-二氢呋喃是抗肿瘤药物的中间体,也用于电子化学品和香料中,可由丙烯为原料合成: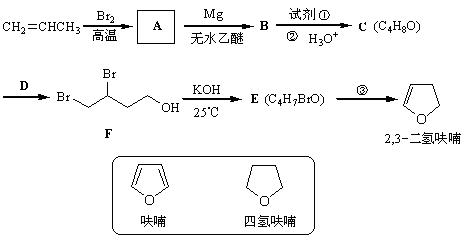
已知: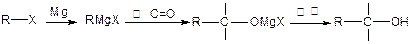
(1)写出A、E的结构简式: A ________________ E ________________。
(2)试剂①是___________,该步反应类型是反应。
(3)反应③的条件是____________,该步还产生另一有机副产物:____________。
(4)写出满足下列条件的呋喃的一种同分异构体的结构简式。
①没有支链,且一取代产物只有两种;②与银氨溶液不发生银镜反应;
(5)四氢呋喃还可以由化合物G (C4H9ClO)在氢氧化钠作用下制得,请写出该反应的方程式___________。
(6)化合物 是合成某些药物的中间体。试设计合理方案由化合物
是合成某些药物的中间体。试设计合理方案由化合物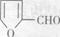 合成
合成 。提示:①合成过程中无机试剂任选;②
。提示:①合成过程中无机试剂任选;②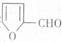 在400摄氏度金属氧化物条件下能发生脱羰基反应;③合成反应流程图表示方法示例如下:
在400摄氏度金属氧化物条件下能发生脱羰基反应;③合成反应流程图表示方法示例如下: