短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3,下列说法正确的是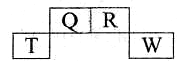
| A.T的离子半径大于W的离子半径 |
| B.RHn,在同族元素的气态氢化物中沸点最低 |
| C.Q与W的原子能形成非极性分子 |
| D.在R的最高价氧化物对应水化物的浓溶液中单质T不溶解,说明未发生化学反应 |
下列属于放热反应的是
| A.2Na+2H2O═2NaOH+H2↑ |
B.CaCO3 CaO+CO2↑ CaO+CO2↑ |
C.C+H2O CO+H2 CO+H2 |
| D.2NH4Cl+Ba(OH)2•8H2O═BaCl2+2NH3↑+10H2O |
已知反应X+Y═M+N为放热反应,对该反应的说法正确是
| A.X的能量一定高于M |
| B.Y的能量一定高于N |
| C.X和Y的总能量一定高于M和N的总能量 |
| D.因为该反应为放热反应,故不必加热就可发生 |
对于放热反应H2+Cl2 2HCl,下列说法正确的是
2HCl,下列说法正确的是
| A.该反应涉及到离子键和共价键的断裂与形成 |
| B.该反应中,化学能只转变为热能 |
| C.断开1molH﹣H键和1molCl﹣Cl键所吸收的总能量,小于形成1molH﹣Cl键所放出的能量 |
| D.反应物所具有的总能量高于产物所具有的总能量 |
今有如下5个热化学方程式:
H2(g)+ O2(g)=H2O(g)△H="a" kJ•mol﹣1
O2(g)=H2O(g)△H="a" kJ•mol﹣1
H2(g)+ O2(g)=H2O(l)△H="b" kJ•mol﹣1
O2(g)=H2O(l)△H="b" kJ•mol﹣1
2H2(g)+O2(g)=2H2O(l)△H="c" kJ•mol﹣1
C(s)+ O2(g)═CO(g)△H=﹣Q1kJ•mol﹣1
O2(g)═CO(g)△H=﹣Q1kJ•mol﹣1
C(s)+O2(g)═CO2(g)△H=﹣Q2kJ•mol﹣1
有关上述反应的叙述错误的是
| A.0<Q1<Q2 |
| B.上述反应中反应物总能量均高于生成物总能量 |
| C.氢气的标准燃烧热是a kJ•mol﹣1,碳的标准燃烧热是Q2kJ•mol﹣1 |
D.a>b= c c |
已知:①2C(s)+O2(g)═2CO(g)△H=﹣221.0kJ•mol﹣1;②2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJ•mol﹣1.则反应C(s)+H2O(g)═CO(g)+H2(g)的△H为
| A.+262.6 kJ•mol﹣1 | B.﹣131.3 kJ•mol﹣1 |
| C.﹣352.3 kJ•mol﹣1 | D.+131.3 kJ•mol﹣1 |