欲配置浓度为1.00mol/L的氯化钠溶液100ml,用不到的仪器是
| A.100ml容量瓶 | B.分液漏斗 | C.玻璃棒 | D.烧杯 |
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
次要:Cu2++CO32-=CuCO3↓(几乎不发生反应。下同)
(2)CuSO4+Na2S
主要:Cu2++S2-=CuS↓
次要:Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
则下列几种物质的溶解度大小的比较中,正确的是( )
| A.CuS<Cu(OH)2<CuCO3 |
| B.CuS>Cu(OH)2>CuCO3 |
| C.Cu(OH)2>CuCO3>CuS |
| D.Cu(OH)2<CuCO3<CuS |
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于难溶物之间转化的说法中错误的是( )
| A.AgCl不溶于水,不能转化为AgI |
| B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质 |
| C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于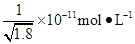 |
下列说法正确的是( )
| A.水的离子积常数Kw随温度改变而改变,随外加酸碱浓度改变而改变 |
| B.一元弱酸的电离常数Ka越小,表示此温度下该一元弱酸电离程度越大 |
| C.对已达到化学平衡的反应,仅改变浓度,若平衡移动则平衡常数(K)一定改变 |
| D.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
现有浓度均为0.1 mol/L的五种电解质溶液:A.Na2CO3、B.NaHCO3、C.NaAlO2、D.CH3COONa、E.NaOH。
(1)这五种溶液中水的电离程度最大的是(填编号)。
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是(填编号)。
(3)将上述A、B、C、D四种溶液两两混合时,有一对溶液相互间能够发生反应,写出该反应的离子方程式:。
(4)将CO2通入A溶液中恰好呈中性,溶液中2c(CO32-)+c(HCO3-)=mol/L (设反应前后溶液体积不变)。
已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题: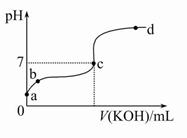
(1)a点溶液中c(H+)为。
(2)b点溶液中离子浓度大小顺序为或或。c点溶液中的离子浓度大小顺序为。
(3)a、b、c三点中水的电离程度最大的是,滴定过程中宜选用作指示剂。