(12分)工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3、SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下: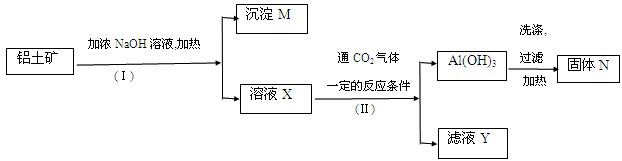
(1)Ⅰ和Ⅱ步骤中分离溶液和沉淀的操作是 。
(2)沉淀M中除含有泥沙外,一定还含有 ,固体N是 。
(3)滤液X中,含铝元素的溶质的化学式为 ,它属于 (选填“酸”、“碱” 或“盐”)类物质。
(4)实验室里常往AlCl3溶液中加入 (选填“氨水”或NaOH溶液)来制取Al(OH)3
短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素原子核外M层电子数目比K层多1个,C―比A元素的离子多1个电子层,D元素的原子核外L层比K层多2个电子。
(1)A离子的离子结构示意图为;
(2)C元素在周期表中的位置是;
(3)A~D四种元素最高价氧化物对应水化物中,酸性最强的是 ;
(4)向B、C两种元素形成的化合物的水溶液里滴入过量氢氧化钠溶液,写出有关离子方程式__________________________________。
(10) A~G各物质间的关系如下图,其中B、D为气态单质。
请回答下列问题: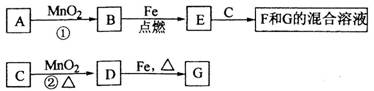
(1)物质C电子式为________________,化合物类型是__________________;E的化学式为。
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为_____________;若只能在加热情况下进行,则反应物A应为____(写化学式);
(3)反应②的离子方程式为_______________________________________;
(4)检验G溶液中阳离子的常用试剂是_____________,实验现象为_________________________________________。
、已知有机物A只由碳、氢两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化工发展水平。一定条件下,A、B、C、D、E有如下转化关系: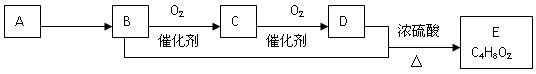
(已知:2RCHO+O2→2RCOOH)
(1)除去甲烷中混有A的试剂是。
(2)请写出B→C的方程式。
(3)请写出B与D反应生成E的化学方式。
(4)某同学设计了下列反应: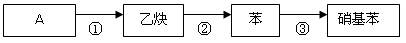
请写出③的反应方程式。
、等温、等压、等质量的气体:H2、D2、T2,则
①密度之比为②质子数之比为
③中子数之比为④体积之比为
将甲烷和乙烯的混合气体共0.2mol通入溴水中,发生反应的化学方程式是 ,反应的类型为 ,若充分反应后溴水增重2.8克,则原混合气体中甲烷和乙烯的物质的量之比为 。