下列反应所产生的气体体积在标准状况下为22.4L的是 ( )
| A.将2mol金属Cu与含2molH2SO4的浓硫酸共热 |
| B.将1 mol MnO2固体与含4molHCl的浓盐酸共热 |
| C.常温下,将32.2g金属钠和5.4g金属铝同时投入到足量水中 |
| D.常温下,将10.8g的Al和22.4g的Fe投入到300g 98%的硫酸中 |
某污水中含CN-a mg·L-1,现用ClO2将CN-氧化,只生成两种无毒气体。处理100 m3这种污水,至少需要ClO2的物质的量为
| A.50a/13 mol | B.50a/26 mol | C.25a/13 mol | D.100a/13 mol |
25 ℃时,下列各组离子在指定溶液中一定能大量共存的是
| A.在强碱性溶液中:Na+、K+、AlO2-、Cl- |
| B.pH=1的溶液中:HCO3-、NH4+、NO3-、Ca2+ |
| C.无色溶液中:Cu2+、NO3-、Cl-、H+ |
| D.无色溶液中:Na+、K+、ClO-、SO32- |
下列有关离子检验的操作和实验结论都正确的是
| 选项 |
实验操作及现象 |
实验结论 |
| A |
向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 |
该溶液中一定含有SO42— |
| B |
向某溶液中先加入几滴KSCN溶液,再滴入酸性高锰酸钾溶液,溶液变为浅红色 |
该溶液中一定含有Fe2+ |
| C |
在酒精灯上加热铝箔,铝箔熔化,但不滴落,好像有一层膜兜着 |
铝易被氧化;铝的熔点比氧化铝低 |
| D |
向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体 |
该溶液中一定含有CO32— |
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下: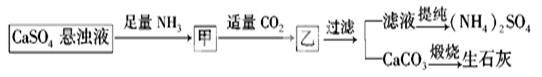
下列推断不合理的是
| A.往甲中通适量CO2有利于(NH4)2SO4生成 |
| B.生成1 mol(NH4)2SO4至少消耗2 molNH3 |
| C.CO2可被循环利用 |
| D.NH3、CO2的通入顺序可以互换 |
利用如图所示装置进行实验,能实现实验目的是(必要时可加热)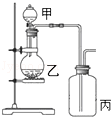
| 选项 |
实验目的 |
甲 |
乙 |
丙 |
| A |
制取并收集NH3 |
浓氨水 |
CaO |
H2O |
| B |
制取并验证碳酸酸性比硅酸强 |
浓盐酸 |
大理石 |
硅酸钠溶液 |
| C |
制取并验证Cl2没有漂白性 |
浓盐酸 |
MnO2 |
干燥的红布条 |
| D |
制取并验证SO2具有漂白性 |
70%硫酸 |
Na2SO3 |
品红试液 |