能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)
ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g)= 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g)= H2O(l) ΔH =-44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol CO和液态水放出的热量为
(3)利用甲醇燃料电池设计如右图所示的装置: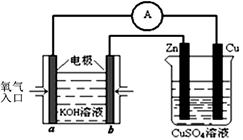
则该装置中Cu极为 极;
写出b极的电极反应式 。
(10分) Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn ;
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+ 的核外电子排布式是。
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。(填写序号)
。(填写序号)
a.稳定性:甲>乙,沸点:甲<乙 b.稳定性:甲>乙,沸点:甲>乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(3)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比 为。
为。
(4)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于;1 mol该晶体中含有mol的化学键
A、B、C、D、E、F都是短周期元素,原子序数依次增大,B、C、D同周期,A、E同主族。A、C能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。B元素原子有两个未成对电子,D是周期表中电负性最大的元素,F是地壳中含量最多的金属元素。根据以上信息回答下列问题:
⑴比较C、D对应氢化物的稳定性(填分子式)
⑵甲、乙两分子中含有非极性共价键的是(填分子式),它的电子式为。
⑶ C、D、E、F的离子中,半径最小的是(填离子符号)
(4)B的氢化物的空间构型是
第一电离能I1是指气态原子X(g)失去 一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,将Na ——Ar之间六种元素用短线连接起来,构成完整的图像。
——Ar之间六种元素用短线连接起来,构成完整的图像。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是
。
(3)上图中6号元素在周期表中的位置是;
其原子M层电子的轨道表示式为。
(4)上图中4,5,6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:。
现有下列几种常见的物质:①N2 ②NaCl ③Ca(OH)2 ④金刚石⑤SiC ⑥NH3⑦NH4Cl ⑧CO2。其中,(以下空格均填写序号)
(1)含有非极性键的分子晶体是;
(2)含有极性键的分子晶体是 ;
;
(3)只含离子键的离子晶体是;
(4)含有极性共价键的原子晶体是;
(5)既含有离子键,又含有极性共价键和配位键的离子晶体是
将一只铝制的易拉罐内充满二氧化碳,然后往罐内注入足量的NaOH溶液,立即用胶布密封罐口,经过一段时间后,罐壁凹瘪,又过一段时间后,瘪了的罐壁重新鼓起来。
(1) 罐壁凹瘪的原因是,反应的化学方程式是:
(2) 瘪罐重新鼓起来的原因是;
反应的离子方程式是。