某有机化合物A的结构简式如图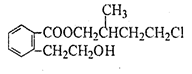 ,回答下列问题:
,回答下列问题:
(1)A的分子式为 。
(2)A在NaOH水溶液中加热得到B和C,C是芳香族化合物,则C的结构简式是 。
(3)B与足量的某饱和一元羧酸D充分反应后生成E,E和B的相对分子质量之差为84,则D的摩尔质量为 。
(4)C酸化后可得F,F不能发生的反应类型是(填写字母代号)  。
。
a.取代反应 b.加成反应 c.消去反应 d.加聚反应
e.氧化反应 f.还原反应
(5)F可以发生如下转化,且G与H互为同分异构体。 
请写出:①H的结构简式 。
②由F生成G的化学方程式 。
(6)符合下列三个条件的F的同分异构体的数目有 个。
①含有邻二取代苯环结构;②与F具有相同的官能团;③不与FeCl3溶液发生显色反应。
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T的单质既可与盐酸反应,又可与NaOH溶液反应,请回答下列问题:
| Q |
R |
||
| T |
W |
(1)T的原子结构示意图为_______________。
(2)元素的非金属性为(原子的得电子能力):Q______ R (填“强于”或“弱于”)
3)、T的硫酸盐溶液与过量NaOH溶液反应的离子方程式为。
4)请写出R与氢形成的氢化物的电子式
5)、Q、R、T、W的原子半径由大到小的顺序为
金属晶体是面心立方体,立方体的每个面5个金原子紧密堆砌(如图其余各面省略),金原子半径为d m,求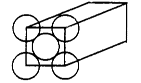
(1)金晶体中最小的一个立方体含有__________个金属原子。
(2) 欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定;
(3)计算一个晶胞的体积是cm3;
(4)金的密度为_________g•cm-3。
(5)列式计算金原子的空间利用率
晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体结构如图所示。
(1)晶体中每个Na+同时吸引着______个Cl-,
每个Cl-同时吸引着_______个Na+。
(2)晶体中在每个Cl-周围与它最接近且距离相等
的Cl-共有________个。
(3)在干冰晶体中每个CO2分子周围紧邻的 CO2分子有___________个,在晶体中截取一个最小的正方形;使正方形的四个顶点部落到CO2分子的中心,则在这个正方形中有___________个C02分子。其中,C原子的杂化类型为。C02分子中碳氧之间有π键,而SiO2中硅氧之间无π键,原因是。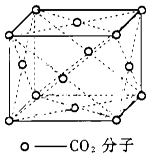
A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A _________ D __________
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(4)D的氢化物比C的氢化物的沸点__________(填"高"或"低"),原因_____________ (5)A、B、C最高价氧化物的晶体类型分别是______晶体、______晶体、______晶体
(5)A、B、C最高价氧化物的晶体类型分别是______晶体、______晶体、______晶体
(6)画出D的核外电子排布图___________________________________________,这样排布遵循了___________原理和____________规则。
⑴某元素原子的价电子构型为3s23p3,它属于第__ __周期,是__ _族,最高正化合价为__ __,元素名称是_。
⑵某元素原子的价电子构型为3s2,它是___ ___区元素,元素符号为_ 。
⑶某元素原子的价电子构型为3d104s2,它属于第 _ 周期,是_族,_区元素,元素符号是。