下表是元素周期表的一部分,请依据该表回答问题。
| 族 周期 |
IA |
|
0 |
|||||
| 1 |
H |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
He |
| 2 |
Li |
Be |
B |
C |
N |
O |
F |
Ne |
| 3 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
(1)下列说法正确的是
| A.可用于半导体材料的元素是碳 |
| B.PH3的稳定性比H2S强 |
| C.第VA族元素的最高价氧化物对应的水化物化学式均为H3RO4 |
| D.H2SiO3的酸性比H3PO4弱 |
E.NaOH的碱性比Mg(OH)2强
(2)第2周期VIIA族元素的原子结构示意图是_______________,该元素与同周期IA族元素组成的化合物类型是。_______________
(3)第3周期元素的最高价氧化物对应水化物中,酸性最强的是 _______________(填化学式,下同);碱性最强的是 _______________ ;具有两性的是 _______________ 。
(16分)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现一氧化还原反应的体系中,反应物和生成物共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是________,化合价没有发生变化的反应物是____________。
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平):_______________。
(3)上述反应中,1 mol氧化剂在反应中________(填“得到”或“失去”)________mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色。说出NaBiO3的一个性质:_____________________________________________________________。
(16分)现有A、B、C、D、E可溶于水的五种化合物,其组成的离子如下表,且每种离子只有一次。
| 阳离子 |
Ag+ Na+ Fe3+ Al3+ Ba2+ |
| 阴离子 |
OH- Cl- SO32— NO SO42— |
某同学将它们分别配成0.1 mol·L-1的溶液,进行操作,发现如下实验现象:
①C溶液显黄色,其它溶液均为无色溶液。
②已知向B、C、D、E溶液分别加入A溶液均产生白色沉淀;
③B溶液与适量E溶液反应生成白色沉淀,加入过量E溶液,白色沉淀量减少,但不完全消失。
(1)据此推断它们的化学式:
A__________;B__________;C________;D________;E________。
(2)B溶液加入少量E溶液的离子方程式____________________________________。
(3)向C溶液滴加少量的D溶液的离子方程式_________________________________。
(14分)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO+5e-+8H+===Mn2++4H2O
(1)写出该氧化还原反应的离子方程式:______________________________________。
(2)该反应中氧化剂是________,被氧化的元素是________;若有0.5 mol H2O2参加此反应,则转移电子个数为________。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为__________________;这时若有0.5 mol H2O2发生分解,则转移电子个数为________。
(8分)煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O  4H++2Fe2++________;
4H++2Fe2++________;
②4Fe2++O2+4H+ 4Fe3++____________;
4Fe3++____________;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2SO42—。
4H++2SO42—。
已知:FeS2中的铁元素为+2价。
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述①②离子方程式补充完整。
(2)反应③的还原剂是________________。
(3)观察上述反应,FeS2最终转化为____________从煤炭中分离出来。
.A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)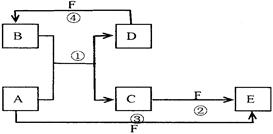
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有有色气体生成,则C的电子式为,反应④的化学方程式为:。
(2)若A为常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是,用电子式表示B分子的形成过程。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为,分子E的结构式为。